题目内容
【题目】(1)已知反应C(s)+H2O(g)CO(g)+H2(g),填写出该反应的平衡常数表达式 K=_____。
(2)写出乙酸电离方程式:_______________________。并写出乙酸电离平衡常数的表达式:K= ____。
(3)用离子方程式表达纯碱溶液为什么可去油污:_____________。
(4)请写CH3COONa溶液的电荷守恒式:__________________________ ,和该溶液各离子浓度从大到小的序列式:___________________________。
(5)写出泡沫灭火器工作原理的离子方程式:____________________________________。
【答案】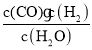 CH3COOH
CH3COOH![]() CH3COO-+H+
CH3COO-+H+ 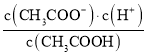 CO32-+H2O
CO32-+H2O![]() HCO3-+OH- c(Na+)+c(H+)=c(CH3COO-)+c(OH-) c(Na+)>c(CH3COO-)>c(OH-)>c(H+) Al3++3HCO3-=Al(OH)3↓+3CO2↑
HCO3-+OH- c(Na+)+c(H+)=c(CH3COO-)+c(OH-) c(Na+)>c(CH3COO-)>c(OH-)>c(H+) Al3++3HCO3-=Al(OH)3↓+3CO2↑
【解析】
(1)平衡常数为可逆化学反应达到平衡状态时,生成物浓度幂之积与反应物的浓度幂之积的比值;
(2)乙酸为弱酸,其电离方程式为CH3COOH![]() CH3COO-+H+;K=
CH3COO-+H+;K=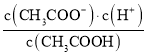 ;
;
(3)纯碱为Na2CO3,为强碱弱酸盐,其溶液中碳酸根离子水解生成碳酸氢根离子和氢氧根离子,使溶液显碱性,油污在碱性条件下水解,生成可溶性的物质;
(4)CH3COONa溶液中,溶液呈电中性,阳离子所带的正电荷总数等于负电荷总数;CH3COONa为强碱弱酸盐,醋酸根离子少量水解,生成醋酸分子和氢氧根离子,导致溶液呈碱性;
(5)泡沫灭火器为硫酸铝与碳酸氢钠,两溶液混合时,发生双水解反应,生成氢氧化铝和二氧化碳。
(1)平衡常数为可逆化学反应达到平衡状态时,生成物浓度幂之积与反应物的浓度幂之积的比值,注意固体和纯液体不能写在表达式中,K=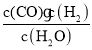 ;
;
(2)乙酸为弱酸,其电离方程式为CH3COOH![]() CH3COO-+H+;K=
CH3COO-+H+;K=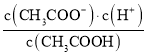 ;
;
(3)纯碱为Na2CO3,为强碱弱酸盐,其溶液中碳酸根离子水解生成碳酸氢根离子和氢氧根离子,使溶液显碱性,油污在碱性条件下水解,生成可溶性的物质,去污的离子方程式为CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
(4)CH3COONa溶液中,溶液呈电中性,阳离子所带的正电荷总数等于负电荷总数,则c(Na+)+ c(H+)= c (CH3COO-)+c(OH-);CH3COONa为强碱弱酸盐,醋酸根离子少量水解,生成醋酸分子和氢氧根离子,导致溶液呈碱性,则离子大小顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(5)泡沫灭火器为硫酸铝与碳酸氢钠,两溶液混合时,发生双水解反应,生成氢氧化铝和二氧化碳,离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑。





