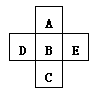
题目内容
(14分)巳知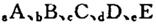 元索,
元索,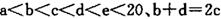 。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
(1) B的原子结构示意图为_________;E在元素周期表中的位置________。
(2) 已知C2及其化合物有以下转化关系(部分物质已省略):
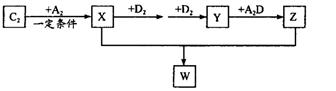
①将已收集满气体Y的试管管口倒扣在水面下,可以观察到的现象是________;其化学反应方程式为________; W的晶体类型为________;将E单质与Z的极稀溶液混合,还原产物只有W,则该反应的离子方程式为________________________。
②上述合成X的反应处于平衡状态时,气体X的浓度为C(X)(如图)。在恒温恒容条件下,t1时刻通人X将X的浓度变为2c(X)。请在下图画出平衡移动过程中X浓度的变化趋势图。

(3) 由其中三种元素形成的只含极性键、具有18电子的共价化合物为________ (写结构简式,至少2种)。
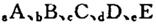 元索,
元索,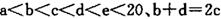 。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。(1) B的原子结构示意图为_________;E在元素周期表中的位置________。
(2) 已知C2及其化合物有以下转化关系(部分物质已省略):

①将已收集满气体Y的试管管口倒扣在水面下,可以观察到的现象是________;其化学反应方程式为________; W的晶体类型为________;将E单质与Z的极稀溶液混合,还原产物只有W,则该反应的离子方程式为________________________。
②上述合成X的反应处于平衡状态时,气体X的浓度为C(X)(如图)。在恒温恒容条件下,t1时刻通人X将X的浓度变为2c(X)。请在下图画出平衡移动过程中X浓度的变化趋势图。

(3) 由其中三种元素形成的只含极性键、具有18电子的共价化合物为________ (写结构简式,至少2种)。
(1)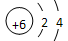 ;第三周期第ⅢA
;第三周期第ⅢA
(2)①红棕色气体逐渐变为无色,气体体积减小到原来的1/3,液面上升(至2/3);3NO2+H2O=NO+2 HNO3;离子晶体;8Al+30H++3NO-=3NH4++8Al3++9H2O
②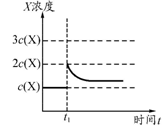
(3)CH3OH、NH2OH、CH3NH2等
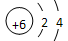 ;第三周期第ⅢA
;第三周期第ⅢA(2)①红棕色气体逐渐变为无色,气体体积减小到原来的1/3,液面上升(至2/3);3NO2+H2O=NO+2 HNO3;离子晶体;8Al+30H++3NO-=3NH4++8Al3++9H2O
②

(3)CH3OH、NH2OH、CH3NH2等
常温常压下密度最小的气体是氢气,A是H。B的单质有多种同素异形体,其中一种为质软灰黑色固体,常见质软灰黑色固体是石墨,即B是碳元素。C的最外层电子数是电子层数的2. 5倍,则只能是氮元素。因为b+d=2c,所以D是氧元素。E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物,说明E既能与酸反应也能与碱反应,是铝元素。
(1)略
(2)根据转化关系可知X、Y、Z、W分别是NH3、NO2、HNO3、NH4NO3。NO2溶于水生成硝酸和NO,方程式为3NO2+H2O=NO+2 HNO3,所以红棕色气体逐渐变为无色,气体体积减小到原来的1/3,液面上升(至2/3)。根据得失电子守恒可写出反应的方程式:8Al+30H++3NO-=3NH4++8Al3++9H2O。
(3)增大氨气浓度,平衡向逆反应方向移动,但平衡后氨气的浓度将大于c (NH3)而小于2 c (NH3),如图所示: 。
。
(3)只含极性键说明不能有铝元素,又因为具有18电子的共价化合物,所以不能同时含有C、N和O,必须含有H元素,故常见的有CH3OH、NH2OH、CH3NH2等
(1)略
(2)根据转化关系可知X、Y、Z、W分别是NH3、NO2、HNO3、NH4NO3。NO2溶于水生成硝酸和NO,方程式为3NO2+H2O=NO+2 HNO3,所以红棕色气体逐渐变为无色,气体体积减小到原来的1/3,液面上升(至2/3)。根据得失电子守恒可写出反应的方程式:8Al+30H++3NO-=3NH4++8Al3++9H2O。
(3)增大氨气浓度,平衡向逆反应方向移动,但平衡后氨气的浓度将大于c (NH3)而小于2 c (NH3),如图所示:
 。
。(3)只含极性键说明不能有铝元素,又因为具有18电子的共价化合物,所以不能同时含有C、N和O,必须含有H元素,故常见的有CH3OH、NH2OH、CH3NH2等

练习册系列答案
相关题目