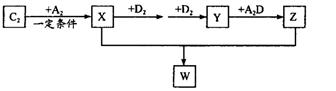
题目内容
(11分)有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序依次增大。C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物。CB可与EA2反应生成C2A和气态物质EB4。E的M层电子数是K层电子数的2倍。
(1)写出A、B、E元素的名称A:__________;B:_______________; E : ;
(2)写出电子式D2A2__________;
(3)写出D单质与CuSO4溶液反应的离子方程式_________________________
(4)C2A是由__________键形成的________分子 (填“极性”或“非极性”);中心原子杂化类型是 ,分子立体构型是 。
(1)写出A、B、E元素的名称A:__________;B:_______________; E : ;
(2)写出电子式D2A2__________;
(3)写出D单质与CuSO4溶液反应的离子方程式_________________________
(4)C2A是由__________键形成的________分子 (填“极性”或“非极性”);中心原子杂化类型是 ,分子立体构型是 。
⑴A 氧 B 氟 E 硅 ⑵
⑶ 2Na + Cu2+ + 2H2O = 2Na+ + Cu(OH)2↓ + H2↑
⑷ 极性 极性 sp3 V形
⑶ 2Na + Cu2+ + 2H2O = 2Na+ + Cu(OH)2↓ + H2↑
⑷ 极性 极性 sp3 V形
E的M层电子数是K层电子数的2倍,则E是硅元素。所以EA2应是SiO2,即A是O。C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物,所以C是H,D是Na。由EB4可知B属于第ⅦA元素,根据原子序数的顺序可知B是F元素。D2A2是过氧化钠,含有离子键和非极性键,电子式为 。钠属于活泼性金属,极易与水反应,所以D单质与CuSO4溶液反应的离子方程式为2Na + Cu2+ + 2H2O = 2Na+ + Cu(OH)2↓ + H2↑。在化合物H2O中,中心原子有2对孤对电子,其VSEPR模型是四面体,碳原子是sp3杂化,但实际构型是 V形,属于极性分子。
。钠属于活泼性金属,极易与水反应,所以D单质与CuSO4溶液反应的离子方程式为2Na + Cu2+ + 2H2O = 2Na+ + Cu(OH)2↓ + H2↑。在化合物H2O中,中心原子有2对孤对电子,其VSEPR模型是四面体,碳原子是sp3杂化,但实际构型是 V形,属于极性分子。
 。钠属于活泼性金属,极易与水反应,所以D单质与CuSO4溶液反应的离子方程式为2Na + Cu2+ + 2H2O = 2Na+ + Cu(OH)2↓ + H2↑。在化合物H2O中,中心原子有2对孤对电子,其VSEPR模型是四面体,碳原子是sp3杂化,但实际构型是 V形,属于极性分子。
。钠属于活泼性金属,极易与水反应,所以D单质与CuSO4溶液反应的离子方程式为2Na + Cu2+ + 2H2O = 2Na+ + Cu(OH)2↓ + H2↑。在化合物H2O中,中心原子有2对孤对电子,其VSEPR模型是四面体,碳原子是sp3杂化,但实际构型是 V形,属于极性分子。
练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
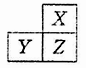
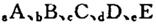 元索,
元索,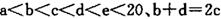 。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。