题目内容
【题目】(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有 NOx、![]() (PAN)、HCOOH、等二次污染物。
(PAN)、HCOOH、等二次污染物。
① 1mol PAN中含有的σ键数目为_______。PAN中C、N、O种元素的第一电离能由大到小的顺序为_________________。
② NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为________,中心离子的核外电子排布式为_______________。
③相同压强下,HCOOH的沸点比CH3OCH3____(填“高”或“低”),其原因是__________________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
① (NH4)2SO4晶体中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
② NH4NO3中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
(3)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用85Kr。已知Kr晶体的晶胞结构如图(甲)所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=_____(填数字)。
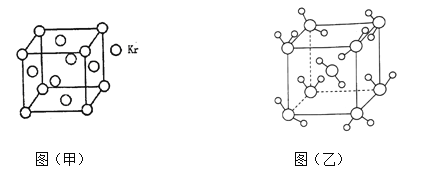
(4)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图(乙)所示。已知晶胞参数a=333.7pm,阿伏加德罗常数的值取6.02×1023,则重冰的密度为_______g.cm-3(计算结果精确到0.01)。
【答案】 10 N>C>O 6 1s22s22p63s23p63d6 或[Ar]3d6 高 HCOOH分子间能形成氢键 de 正四面体 sp2 3 1.61
【解析】分子中任何两个相邻的原子之间只能形成1个σ键。元素的非金属性越强的,其第一电离能一般越大,但是第一电离能还与原子结构的稳定性有关,在同一周期中,第IIA和第VA的元素的第一电离能高于邻近的两种元素。配合物中的内界由中心原子和配体构成。相对分子质量相近的物质,分子间能形成氢键的沸点通常高于分子间不能形成氢键的。根据中心原子的价层电子对数可以判断其杂化类型。由重冰的结构示意图可知,其晶胞为体心立方,每个晶胞中有2个水分子,根据晶胞的质量和体积可以求其密度。
(1)① 1mol PAN(![]() )中含有的σ键数目为10。PAN中C、N、O种元素的第一电离能由大到小的顺序为N>C>O。
)中含有的σ键数目为10。PAN中C、N、O种元素的第一电离能由大到小的顺序为N>C>O。
② NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为6,中心离子为Fe2+,其核外电子排布式为1s22s22p63s23p63d6 (或[Ar]3d6)。
③相同压强下,HCOOH的沸点比CH3OCH3高,其原因是HCOOH分子间能形成氢键。
(2)① (NH4)2SO4晶体是离子晶体,其中各种微粒间的作用力有离子键、共价键、配位键,不涉及范德华力和氢键,故选d、e。
② NH4NO3中,阳离子中N和阴离子中的N的杂化方式不同,前者为sp3、后者为sp2,故阳离子的空间构型为正四面体。
(3)由Kr晶体的晶胞结构示意图可知,该晶胞为面心立方,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m=12、n=4,故m/n=3。
(4)由重冰的结构示意图可知,其晶胞为体心立方,每个晶胞中有2个水分子。已知晶胞参数a=333.7pm,阿伏加德罗常数的值取6.02×1023,则1mol重冰晶胞的质量和体积分别为36g、![]() ,所以,重冰的密度为
,所以,重冰的密度为![]() = 1.61g.cm-3。
= 1.61g.cm-3。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.汽车尾气排放的NOX和CO污染环境,在汽车尾气系统中安装催化转化器,可有效降低NOX和CO的排放。
已知:①2CO(g)+O2(g)![]() 2CO2(g), △H=-566.0kJ·mol-1
2CO2(g), △H=-566.0kJ·mol-1
②N2(g)+O2(g)![]() 2NO(g)△H=+180.5 kJ·mol-1
2NO(g)△H=+180.5 kJ·mol-1
回答下列问题:
(1)CO的燃烧热为___________,若1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946kJ、498kJ的能量,则1molNO(g)分子中化学键断裂时需吸收的能量为___________kJ。
(2)为了模拟反应2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表:
2CO2(g)+N2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4 kJ·mol-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3kJ·mol-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)___________。
②能说明上述反应达到平衡状态的是___________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
(3)在某恒容容器中发生下列反应:2NO2(g)![]() 2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。
2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。

该反应为___________反应(填“吸热”或“放热”),已知图中a点对应温度下,NO2的起始压强P0为120kPa,计算该温度下反应的平衡常数Kp的值为___________。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅱ.N2H4-O2燃料电池是一种高效低污染的新型电池,其装置如图所示:

N2H4的电子式为___________;a极的电极反应方程式为___________;
【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表:
X | Y | Z | M | R | Q | |
原子半径/nm | 0.099 | 0.186 | 0.074 | 0.143 | ||
主要化合价 | +4,-4 | -2 | -1,+7 | +3 | ||
其他 | 常温下为黄色固体 | 无机非金属材料的主角 | 颜色反应为黄色 | 其氧化物可做耐火材料 |
(1)Q在元素周期表中的位置是______.
(2)Y与R相比,非金属性较强的是________(用元素符号表示),下列事实能证明这一结论的是______(填字母序号)
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性:HR>YH4
c.Y与R形成的化的中Y呈正价
(3)根据表中数据推测,Y的原子半径的最小范围是______.
(4)甲、乙是上述某些元素的最高价氧化物对应的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是______.
(5)已知1mo1XM2(g)被氧化为1mo1XM3(g)的△H=﹣99kJ/mo1.写出由XM2生成XM3的热化学反应方程式 ________。
【题目】如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是
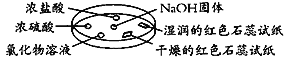
选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应生成了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
D | 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
A. AB. BC. CD. D
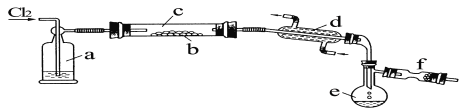
【题目】氯化铁可用作金属蚀刻、有机合成的催化剂,研究其制备及性质是一个重要的课题。
(1)氯化铁晶体的制备(夹持及加热装置省略):

①实验过程中装置丙中可能发生反应的离子方程式有____________。
②该装置气密性检查方法及操作:_________________________。
(2)氯化铁的性质探究:
为探究氯化铁的性质设计了如下实验。(查阅文献知:①氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2 ②FeCl2熔点670℃)

操作步骤 | 实验现象 | 解释原因 |
打开K,充入氮气 | D中有气泡产生 | ①充入N2的原因___________。 |
关闭K,加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因__________________________。 |
实验结束,振荡C静置 | ③_____________ | ④________________________。(用方程式解释) |