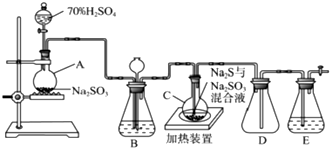
题目内容
20.现有部分短周期元素的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式
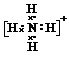 (用元素符号表示)
(用元素符号表示)(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
非金属性强弱的判断方法有很多种,请写出另一种判断方法(用化学方程式表示):
Cl2+H2S=2HCl+S↓.
分析 短周期元素中,T元素原子的M层上有2对成对电子,外围电子排布为3s23p4,则T为S元素;X元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;常温下Y单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;元素Z的最高正价是+7价,则Z为Cl.
解答 解:短周期元素中,T元素原子的M层上有2对成对电子,外围电子排布为3s23p4,则T为S元素;X元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;常温下Y单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;元素Z的最高正价是+7价,则Z为Cl.
(1)元素T为S元素,最外层电子排布为3s23p4,共有6种不同运动状态的电子.元素X的一种同位素可测定文物年代,这种同位素的符号是146C,
故答案为:6;146C;
(2)元素Y与氢元素形成离子NH4+,该微粒的电子式为: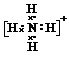 ,故答案为:
,故答案为: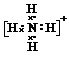 ;
;
(3)元素Z(Cl)与元素T(S)相比,非金属性较强的是Cl,
a.单质状态属于物理性质,不能比较非金属性强弱,故a错误;
b.氢化物稳定性与元素非金属性一致,Z的氢化物比T的氢化物稳定,说明Z的非金属性强,故b正确;
c.非金属性单质与氢氧化钠溶液能否反应不能判断非金属性强弱,故c错误;
非金属性强弱的判断方法有很多种,还可以利用元素单质之间相互置换等进行判断,反应方程式为:Cl2+H2S=2HCl+S↓,
故答案为:Cl;b;Cl2+H2S=2HCl+S↓.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意掌握金属性、非金属性强弱比较实验事实.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
10.配制一定物质的量浓度的Na2CO3溶液,不需要使用的仪器是( )
| A. | 胶头滴管 | B. | 烧瓶 | C. | 玻璃棒 | D. | 容量瓶 |
11.下列离子方程式中,正确的是( )
| A. | 盐酸滴在大理石上:2H++CO32-═CO2↑+H2O | |
| B. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| C. | 向NaOH溶液中通入过量CO2:OH-+CO2═HCO3- | |
| D. | 氢氧化钙与过量NaHCO3溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O |
12.下列过程一定放出热量的是( )
| A. | 化合反应 | B. | 分解反应 | C. | 由原子形成分子 | D. | 由分子变成原子 |
9.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 中性溶液Cu2+、Al3+、NO3-、SO42- | |
| B. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | $\frac{{K}_{W}}{c{(H}^{+})}$=10-13mol•L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3- | |
| D. | c(I-)=0.1 mol•L-1的溶液中:Na+、H+、ClO-、SO42- |
10.未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生.下列各项中属于最有希望的新能源的是( )
①天然气 ②煤 ③核能 ④水电 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能.
①天然气 ②煤 ③核能 ④水电 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能.
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ③④⑨⑥ | D. | 除①②外 |