题目内容
【题目】16.8 g Fe 跟一定量浓 HNO3 反应,Fe 全部溶解,共收集 NO、NO2 的总体积为 11.2 L(标准状况),所得溶液中 H+的物质的量为 0.02 mol,请回答:
(1)反应中被还原的硝酸为_______________mol。
(2)反应过程中转移电子数为_______________。
(3)生成的 NO 与 NO2 的物质的量之比为__________________。
(4)反应后溶液中 NO3-的物质的量为___________mol。
(5)写出该反应的离子方程式:___________________________。
【答案】0.5 0.9NA 2:3 0.92 3Fe + 14H+ + 5NO3 - === 3Fe3+ + 2NO2↑ + 3NO ↑+7H2O
【解析】
由题意知浓硝酸的量“一定”,铁跟浓硝酸反应时HNO3被还原为NO2,当浓硝酸逐渐变稀后,HNO3被还原为NO。根据电子得失守恒和元素守恒进行相关计算。
(1)HNO3被还原的产物是NO和NO2气体,11.2LNO和NO2混合气体总物质的量=![]() =0.5mol,根据氮元素守恒可知,反应中被还原的硝酸物质的量为0.5mol。
=0.5mol,根据氮元素守恒可知,反应中被还原的硝酸物质的量为0.5mol。
(2)由题意知最后溶液中仍有H+,说明HNO3过量,16.8gFe全部溶解,说明反应中转移的电子数由16.8gFe决定。16.8gFe的物质的量=![]() =0.3mol,反应中每个Fe原子失去3个电子,所以0.3molFe失去电子的物质的量=0.3mol×3=0.9mol,即反应过程中转移电子数为0.9NA。
=0.3mol,反应中每个Fe原子失去3个电子,所以0.3molFe失去电子的物质的量=0.3mol×3=0.9mol,即反应过程中转移电子数为0.9NA。
(3)由反应中电子得失守恒可知,生成0.5molNO和NO2混合气体时HNO3共得到0.9mol电子,由化合价变化知HNO3~NO~得3e-,HNO3~NO2~得1e-,设混合气体中含有NO和NO2的物质的量分别为n(NO)、n(NO2),有方程式组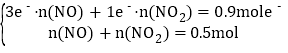 ,解得
,解得![]() ,因此,生成的NO与NO2的物质的量之比为0.2mol:0.3mol=2:3。
,因此,生成的NO与NO2的物质的量之比为0.2mol:0.3mol=2:3。
(4)反应得到的是HNO3和Fe(NO3)3混合溶液,其中HNO3的物质的量为0.02mol,Fe(NO3)3的物质的量为0.3mol,所以反应后溶液中NO3-的物质的量=0.02mol+0.3mol×3=0.92mol。
(5)根据上述分析可知,铁与硝酸反应生成Fe3+、NO、NO2和H2O,其中NO与NO2计量数之比为2:3,根据电子得失守恒、电荷守恒、质量守恒配平,该反应的离子方程式为:3Fe+14H++5NO3 -=3Fe3++2NO2↑+3NO↑+7H2O。