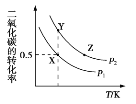
题目内容
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是( )
A. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
B. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡: NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
【答案】A
【解析】
100℃时,水的离子积常数Kw=1×l0-12,纯水的pH=6,该温度下pH=11的氨水,c(H+)=10-11mol/L,据此分析。
A.100℃时,pH=11的氨水中H2O电离出来的H+浓度等于10-11mol/L,温度降低至25℃时,水的离子积常数变小,氨水的电离程度减小,氢氧根离子浓度减小,抑制水的电离程度减小,则该氨水溶液中H2O电离出的H+浓度小于10-11mol/L,故A正确;
B.向该溶液中加入同温同体积pH=1的盐酸,氨水过量,反应后溶液显碱性,故B错误;
C.向该氨水溶液中加入NH4Cl溶液,铵根离子浓度增大,电离平衡逆向移动,NH3·H2O的电离能力减弱,故C错误;
D.硫酸铵是强酸的酸式盐,是强电解质,电离方程式为:NH4HSO4(aq)=NH4+(aq)+H+(aq)+SO42-(aq),故D错误。
故选A。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
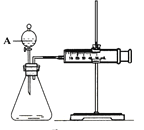
应用题点拨系列答案【题目】用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7克镁带,按右图连接好装置,从A中加入20.0mL 0.5mol/LH2SO4。记录注射器活塞的位置和相应的时间。记录数据如下:
时间/s | 0 | t | 2t | ...... |
活塞的位置/mL | 17.3 | 25.6 | 36.6 | ...... |
(1)检查该装置气密性的方法是 ___________________。
(2)仪器A的名称是__________________________。
(3)0-t时间段与t-2t时间段,化学反应速率最快的是_______,原因是______________。
(4)用上述装置探究Fe3+、Cu2+对双氧水分解速率的影响,所用试剂:5%H2O2、0.1mol/LFeCl3、0.2mol/LCuCl2,完成下表的实验设计:
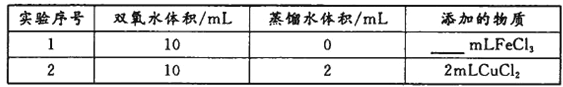
①上表中需要添加的物质是_________mL FeCl3溶液。
②本实验需要测定的数据是____________________________。
(5)为确定MnO2催化双氧水分解的最佳条件,用该实验装置进行实验,反应物用量和反应停止的时间数据如下表。
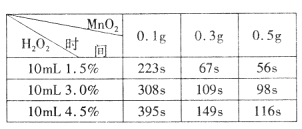
分析表中数据回答下列问题:
①相同浓度的过氧化氢的分解速率随着MnO2用量的增加而_______(填“加快”、“减慢”或“不变”)。
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入__________ g的MnO2为较佳选择。
③该小组的某同学分析上述数据后认为:“当用相同质量的MnO2时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确?______(填“正确”或“不正确”),理由是_____________。(提示:H2O2溶液的密度可认为近似相等。)
(6)50mL0.50 mol·L-1的盐酸与50mL0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。
请回答下列问题:从实验装置上看,图中尚缺少的一种玻璃仪器是____________________,烧杯间填满碎泡沫塑料的作用是____________________________________。大烧杯上如不盖硬纸板,则求得的中和热数值____________(填“偏大” “偏小”或“无影响”)。
(7)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.3 | 20.5 | 25.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________(结果保留一位小数)。