题目内容
某温度下向20mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化)。下列说法中正确的是( )

c (CH3COOH) + c (H+) > c (OH-)

| A.该温度下醋酸的电离平衡常数约为1×10-5mol·L-1 |
| B.图中V1 > 20mL,且a点对应的溶液中: c (Na+)+ c (H+) = c (OH-)+ c (CH3COO-) |
| C.图中V1 < 20mL,且a点对应的溶液中: c (CH3COOH) + c (CH3COO-)<c (Na+) |
| D.当加入Na OH溶液的体积为20mL时,溶液中: |
A
A正确,醋酸的电离常数 ;B错,若V1 = 20mL,则CH3COOH与NaOH恰好完全反应生成CH3COONa,溶液显碱性,因溶液此时显中性,所以,V1 < 20mL;C错,由于解得,V1 < 20mL,所以此时溶液中的溶质为CH3COONa和CH3COOH,即可得c (CH3COOH) + c (CH3COO-)>c (Na+);D错,,若V1 = 20mL,溶液中的溶质为CH3COONa,c (CH3COOH) + c (H+) =" c" (OH-);
;B错,若V1 = 20mL,则CH3COOH与NaOH恰好完全反应生成CH3COONa,溶液显碱性,因溶液此时显中性,所以,V1 < 20mL;C错,由于解得,V1 < 20mL,所以此时溶液中的溶质为CH3COONa和CH3COOH,即可得c (CH3COOH) + c (CH3COO-)>c (Na+);D错,,若V1 = 20mL,溶液中的溶质为CH3COONa,c (CH3COOH) + c (H+) =" c" (OH-);
 ;B错,若V1 = 20mL,则CH3COOH与NaOH恰好完全反应生成CH3COONa,溶液显碱性,因溶液此时显中性,所以,V1 < 20mL;C错,由于解得,V1 < 20mL,所以此时溶液中的溶质为CH3COONa和CH3COOH,即可得c (CH3COOH) + c (CH3COO-)>c (Na+);D错,,若V1 = 20mL,溶液中的溶质为CH3COONa,c (CH3COOH) + c (H+) =" c" (OH-);
;B错,若V1 = 20mL,则CH3COOH与NaOH恰好完全反应生成CH3COONa,溶液显碱性,因溶液此时显中性,所以,V1 < 20mL;C错,由于解得,V1 < 20mL,所以此时溶液中的溶质为CH3COONa和CH3COOH,即可得c (CH3COOH) + c (CH3COO-)>c (Na+);D错,,若V1 = 20mL,溶液中的溶质为CH3COONa,c (CH3COOH) + c (H+) =" c" (OH-);
练习册系列答案
相关题目


 )=c(H+)+ c(CH3COOH)
)=c(H+)+ c(CH3COOH)
 盐酸滴入20.00mL 1.000mol
盐酸滴入20.00mL 1.000mol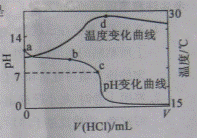



 电离吸热
电离吸热