题目内容
(8分)用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用________(填编号字母)作指示剂。
A.甲基橙 B.石蕊
C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视______________;在铁架台上垫一张白纸,其目的是________________________________________________________________________
________________________________________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol·L-1,烧碱样品的纯度是________。
(5)下列实验操作会对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果________。
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用________(填编号字母)作指示剂。
A.甲基橙 B.石蕊
C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视______________;在铁架台上垫一张白纸,其目的是________________________________________________________________________
________________________________________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol·L-1,烧碱样品的纯度是________。
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度 (mL) | 滴定后的刻度 (mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果________。
(1)A'(2)B'(3)锥形瓶内溶液颜色的变化'便于观察锥形瓶内液体颜色的变化,减小滴定误差
(4)0.4000'97.56%'(5)①偏高'②偏高
(4)0.4000'97.56%'(5)①偏高'②偏高
(1)称量氢氧化钠等易潮解、腐蚀性强的试剂时,样品应放在小烧杯中;(2)酸碱中和滴定时,一般应选甲基橙、酚酞、甲基红等颜色变化较明显的指示剂,石蕊在酸或碱溶液中颜色比较淡,颜色变化不明显,易造成误差;(4)根据c待测=分别求第一、二次的值,再求平均值,解得c(NaOH)=0.4000 mol·L-1;(5)①中V标偏大,故浓度偏高;②中V标偏大,c待测也偏高。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

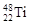 与
与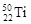 两种核素均是周期表第四周期主族元素
两种核素均是周期表第四周期主族元素
 液面处的读数是a,则滴定管中剩余液体的体积是______mL
液面处的读数是a,则滴定管中剩余液体的体积是______mL 各待盛溶液润洗。
各待盛溶液润洗。