题目内容
关于浓度均为0.1 mol/L的三种溶液:①CH3COOH、②NaOH、③CH3COONa溶液,下列说法不正确的是
| A.c(CH3COO-):③>① |
| B.水电离出的c(OH-):②>① |
C.①和②等体积混合后的溶液: c(OH )=c(H+)+ c(CH3COOH) )=c(H+)+ c(CH3COOH) |
D.①和③等体积混合后的溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH ) ) |
BD
溶液浓度均为0.1 mol/L, CH3COOH为弱电解质部分电离而CH3COONa为强电解质完全电离,故c(CH3COO-):③>①,A正确;CH3COOH为弱电解质而NaOH为强电解质完全电离,对水的电离抑制程度大,故水电离出的c(OH-):①>②,B错误;①和②等体积混合恰好完全反应生成CH3COONa,溶液中存在的平衡有:H2O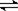 H++OH—,CH3COO—+H2O
H++OH—,CH3COO—+H2O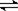 CH3COOH+OH—,故c(OH
CH3COOH+OH—,故c(OH )=c(H+)+ c(CH3COOH),C正确;D选项依据电荷守恒阳离子浓度不可能都大,D错误。
)=c(H+)+ c(CH3COOH),C正确;D选项依据电荷守恒阳离子浓度不可能都大,D错误。
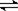 H++OH—,CH3COO—+H2O
H++OH—,CH3COO—+H2O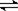 CH3COOH+OH—,故c(OH
CH3COOH+OH—,故c(OH )=c(H+)+ c(CH3COOH),C正确;D选项依据电荷守恒阳离子浓度不可能都大,D错误。
)=c(H+)+ c(CH3COOH),C正确;D选项依据电荷守恒阳离子浓度不可能都大,D错误。
练习册系列答案
相关题目
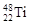 与
与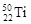 两种核素均是周期表第四周期主族元素
两种核素均是周期表第四周期主族元素