题目内容
【题目】镁、硅及其化合物用途非常广泛。回答下列问题:
(1)基态Si原子价层电子的电子排布图(轨道表达式)为__________,基态Mg原子电子占据最高能级的电子云轮廓图为__________形。
(2)Mg2C3与水反应可生成H2C=C=CH2,中间的碳原子杂化方式是__________,反应所涉及的元素中电负性最大的是__________(填元素符号),Mg2C3和H2C=C=CH2中均存在(填字母)__________。
A.配位键 B.σ键 C.π键 D.氢键
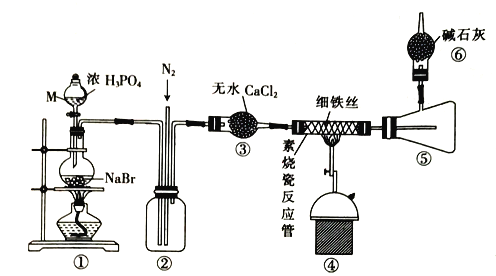
(3)MgO晶格能可通过图1的bom- Haber循环计算得到。
Mg的第二电离能为__________kJ·mol-1;O=O键的键能为_________kJ·mol-1;MgO的晶格能为__________kJ·mol-1。
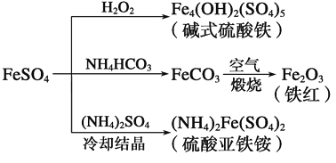
(4)Mg2Si晶胞结构如图2所示,已知其密度为1.94g·cm-3,NA为阿伏加德罗常数的值。
①则晶胞参数a=__________nm(列出计算式)
②Mg2Si的另一种表示中,四个Mg处于上图所示立方体中的Si的位置,则Si处于____________。
【答案】![]() 球 sp O BC 1451 498 3845
球 sp O BC 1451 498 3845 ![]() 顶点和面心(注:如图
顶点和面心(注:如图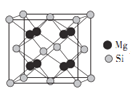 )
)
【解析】
(1)基态Si原子价层电子的电子排布图(轨道表达式)为![]() ;基态Mg原子电子占据最高能级的是3s能级;
;基态Mg原子电子占据最高能级的是3s能级;
(2)Mg2C3与水反应可生成H2C=C=CH2,中间的碳原子形成2个σ键和2个π键,杂化方式是SP,反应所涉及的元素有O、H、Mg、C,电负性最大的是O,Mg2C3和H2C=C=CH2中均存在(填字母)σ键和π键。
(3)图中Mg+(g)+O(g)到Mg2+(g)+O(g)读出Mg的第二电离能为1451kJ·mol-1;从Mg(g)+1/2O2(g)到Mg(g)+O(g)算出O=O键的键能为738kJ·mol-1-249kJ·mol-1=498kJ·mol-1;
晶格能又叫点阵能。它是在OK时1mol离子化合物中的正、负离子从相互分离的气态结合成离子晶体时所放出的能量。用化学反应式表示时,相当于下面反应式的内能改变量Mg2+(g)+O2-(g)=MgO(S)+U(晶格能)。MgO的晶格能为3845kJ·mol-1。
(4)ρ=m/V,平均每个晶胞拥有Mg:8×1/8+6×1/2+12×1/3+1=8,Si:4,由1.94g·cm-3=4×(24×2+28)/NAa3,计算①则晶胞参数a;
②Mg2Si的另一种表示中,四个Mg处于上图所示立方体中的Si的位置,则Si处于顶点和面心。
(1)基态Si原子价层电子的电子排布图(轨道表达式)为![]() ;基态Mg原子电子占据最高能级的是3s能级,电子云轮廓图为球形。;
;基态Mg原子电子占据最高能级的是3s能级,电子云轮廓图为球形。;
(2)Mg2C3与水反应可生成H2C=C=CH2,中间的碳原子形成2个σ键和2个π键,价层电子对数为2,杂化方式是SP,反应所涉及的元素有O、H、Mg、C,电负性最大的是O,Mg2C3和H2C=C=CH2中均存在(填字母)σ键和π键。
(3)图中Mg+(g)+O(g)到Mg2+(g)+O(g)读出Mg的第二电离能为1451kJ·mol-1;从Mg(g)+1/2O2(g)到Mg(g)+O(g)算出O=O键的键能为738kJ·mol-1-249kJ·mol-1=498kJ·mol-1;
晶格能又叫点阵能。它是在OK时1mol离子化合物中的正、负离子从相互分离的气态结合成离子晶体时所放出的能量。用化学反应式表示时,相当于下面反应式的内能改变量Mg2+(g)+O2-(g)=MgO(S)+U(晶格能)。MgO的晶格能为3845kJ·mol-1。
(4)Mg2Si晶胞结构如图2所示,已知其密度为1.94g·cm-3,NA为阿伏加德罗常数的值。ρ=m/V,平均每个晶胞拥有Mg:8×1/8+6×1/2+12×1/3+1=8,Si:4,由1.94g·cm-3=4×(24×2+28)/NAa3,①则晶胞参数a=![]() nm(列出计算式)
nm(列出计算式)
②Mg2Si的另一种表示中,四个Mg处于上图所示立方体中的Si的位置,则Si处于顶点和面心(注:如图 )。
)。

 53随堂测系列答案
53随堂测系列答案【题目】25℃ 时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. 2ClO-+CO2+H2O = CO32-+2HClO
b. ClO-+CH3COOH = CH3COO-+HClO
c. CO32-+2HClO = CO2↑+H2O+2ClO-
d. CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
(4)用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是________(填字母)。
a.c(CH3COOH)/c(H+) b.c(CH3COO-)/c(CH3COOH) c.c(H+)/Ka d.c(H+)/c(OH-)
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。
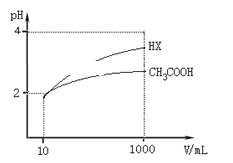
则醋酸的电离平衡常数________(填“>”、“=”或“<”,下同)HX的电离平衡常数;稀释后,醋酸溶液中水电离出来的c(H+)____ HX溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸________HX。
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确数值)。