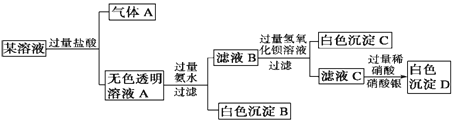
题目内容
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质。下列说法错误的是( )
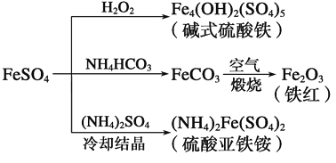
A. 碱式硫酸铁水解能产生 Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3 分解,生产FeCO3需在较低温度下进行
C. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4 的大
D. 可用KSCN溶液检验(NH4)2Fe(SO4)2 是否被氧化
【答案】C
【解析】
A.根据Fe3+能发生水解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附性,可用作净水剂;B.根据NH4HCO3不稳定,受热易分解;C.根据溶解度大的沉淀可以转化为溶解度小的沉淀;D.KSCN溶液遇Fe2+溶液无现象,遇Fe3+溶液变红。
A.碱式硫酸铁电离产生Fe3+,Fe3+能发生水解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附性,可用作净水剂,选项A正确;B.NH4HCO3不稳定,受热易分解,所以为防止NH4HCO3分解,生产FeCO3需在较低温度下进行,选项B正确;C.(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的小,所以FeSO4才能与(NH4)2SO4反应生成(NH4)2Fe(SO4)2,选项C错误;D.KSCN溶液遇Fe2+溶液无现象,(NH4)2Fe(SO4)2若被氧化则生成Fe3+,KSCN溶液遇Fe3+溶液变红,选项D 正确;答案选C。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】对处于元素周期表中下列位置的①~⑩十种元素,根据有关要求回答:
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)能形成共价键的元素共有____种。
(2)只需形成一个共价单键就能达到稳定结构的元素有_______ (填元素符号)。
(3) 彼此间形成共价化合物数量最多的两种元素分别是____(填元素符号)。
(4)写出⑩的最低正价含氧酸电子式________;
写出含氧量最高的离子化合物与共价化合物的电子式__________、___________
(5)写出 ①⑤⑦⑨形成的化合物熔融状态下的电离方程式:_____________________
写出该化合物与⑧的最高价氧化物反应的离子方程式______________________
(6)气态氢化物溶于水呈碱性的元素是____(填元素名称),写出其气态氢化物与其最高价氧化物对应的水化物反应的离子方程式:_____________________________
(7)某元素气态氢化物为H2B,最高价氧化物含B的质量分数为40%,气态氢化物的化学式为__,它与③形成的化合物的化学式为___,含有的化学键类型是____。
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)化学性质最不活泼的元素原子的原子结构示意图为________;
(2)比较元素①、②的简单氢化物的稳定性______________________(用化学式表示);
(3)元素的最高价氧化物对应的水化物中酸性最强的是________,碱性最强的是_______,呈两性的氢氧化物是_______________,(填写化学式) 元素③的最高价氧化物对应水化物中含有的化学键类型为________________;
(4)在③~⑦元素中,简单离子半径最小的是_________;
(5) Na2O2的电子式为___________;CO2的电子式为_________;
(6)在⑦与⑩的单质中,氧化性较强的是_______________,用化学反应方程式证明:_____________________________。