��Ŀ����
����Ŀ��ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ�������ʣ�O2��H2CrO4��Cr(OH)3��H2O��H2O2�� ��֪�÷�Ӧ��H2O2ֻ�������¹��̣�H2O2��O2
(1)�÷�Ӧ�еĻ�ԭ����______________�����ѧʽ��
(2)�÷�Ӧ�У�������ԭ��Ӧ�Ĺ�����________��________�����ѧʽ��
(3)д���÷�Ӧ�Ļ�ѧ����ʽ�����õ����ű������ת�Ƶķ������Ŀ��____________________________________________________________��
(4)�練Ӧת����0.3 mol���ӣ�������������ڱ�״�������Ϊ__________��
(5)��Ӧ8NH3+3Cl2=6NH4Cl+N2�У��������뻹ԭ�������ʵ���֮����_________��
(6)KClO3���ԺͲ���(H2C2O4)�����ᷴӦ���ɸ�Ч������ɱ����ClO2��������CO2��KHSO4�����ʡ�д���÷�Ӧ�Ļ�ѧ����ʽ��______________________________________��
���𰸡�H2O2 H2CrO4 Cr(OH)3 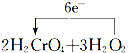 =2 Cr(OH)3+3O2��+2H2O 3.36L��3360mL�� 3:2 KClO3+H2C2O4+H2SO4=ClO2+CO2+KHSO4+2H2O
=2 Cr(OH)3+3O2��+2H2O 3.36L��3360mL�� 3:2 KClO3+H2C2O4+H2SO4=ClO2+CO2+KHSO4+2H2O
��������
��1��Ԫ�ػ��ϼ����߱���������ԭ����
��2��������������ԭ��Ӧ����Ԫ�ػ��ϼ۽��͵�����Ϊ��������
��3���õ����ŷ��������ת�Ƶķ������ĿΪ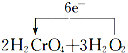 ��
��
��4������������ԭ��Ӧ�е�ʧ�����жϣ�
��5��3Cl2+8NH3�T6NH4Cl+N2�У�ClԪ�صĻ��ϼ۽��ͣ� NԪ�صĻ��ϼ����ߣ�
��6��KClO3�Ͳ��ᣨH2C2O4�������������·�Ӧ����ClO2��CO2��KHSO4��
��1������ϢH2O2��O2�п�֪��OԪ�صĻ��ϼ���-1�����ߵ�0����H2O2Ϊ��ԭ����
��2��������������ԭ��Ӧ����Ԫ�ػ��ϼ۽��͵�����Ϊ����������CrԪ�صĻ��ϼ۽��ͣ�����ԭ��Ӧ�Ĺ���ΪH2CrO4��Cr(OH)3���ʴ�Ϊ��H2CrO4��Cr(OH)3��
��3���÷�Ӧ��OԪ��ʧ���ӣ�CrԪ�صõ����ӣ�2molH2CrO4��Ӧת�Ƶ���Ϊ2mol����6-3��=6mol�����õ����ŷ��������ת�Ƶķ������ĿΪ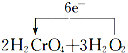 =2 Cr(OH)3+3O2��+2H2O��
=2 Cr(OH)3+3O2��+2H2O��
��4����2H2CrO4+3H2O2�T2 Cr(OH)3+3O2��+2H2O��֪������3mol����ת��6mol���ӣ���ת����0.3mol���ӣ����������������ʵ���Ϊ![]() ��3mol=0.15mol�����ڱ�״�������Ϊ0.15mol��22.4L/mol=3.36L=3360mL��
��3mol=0.15mol�����ڱ�״�������Ϊ0.15mol��22.4L/mol=3.36L=3360mL��
��5��3Cl2+8NH3�T6NH4Cl+N2�У�ClԪ�صĻ��ϼ۽��ͣ����ϼ۽���Ԫ�����ڵķ�Ӧ��������������������ΪCl2��NԪ�صĻ��ϼ����ߣ����ϼ�����Ԫ�����ڵķ�Ӧ���ǻ�ԭ������ԭ����NH3���ɷ�Ӧ��֪3mol������������2mol��ԭ��������Ӧ�����غ㣬���������뻹ԭ�������ʵ���֮��Ϊ3��2��
��6��KClO3�Ͳ��ᣨH2C2O4�������������·�Ӧ����ClO2��CO2��KHSO4����Ӧ�ķ���ʽΪ��2KClO3+H2C2O4+2H2SO4=2ClO2��+2CO2��+2KHSO4+2H2O��






