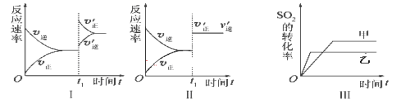
��Ŀ����
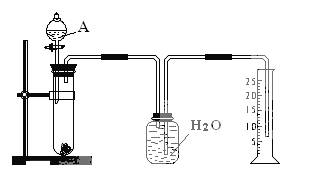
����Ŀ��ijͬѧ�����һ����ʵ�飨��ͼ��ʾ�����Բⶨþ���Ͻ������������������ɹ�ѡ�õ��Լ��У�ŨH2SO4��Ũ���ᡢ6 mol��l-1NaOH��Һ��
����д���пհף�
��1���й�ʵ�������a�����Թ��з������������Ͻ���Ʒ��b���ӷ�Һ©�����Թ��м��������A��Һ��c�����װ�õ������ԣ�d���ⶨ�ռ�����ˮ�������
��ȷ�IJ���˳��Ϊ_________________________________________��
��2��A��Һ��ѡ��________________________________________
��3����ʵ���в����Ʒ������ΪW g �����������Ϊa L����״����������Ʒ��Al����������Ϊ_______________________________________��
���𰸡�cabd 6mol��l-1NaOH��Һ 9a/11.2w��100%
��������
����ˮ���ռ�����,ʵ����ͨ���ⶨ�������������,���ݼ���ȷ���Ͻ���Al����������,
(1)�ռ���������,����ҩƷǰ�ȼ���װ�õ�������,Ȼ����Ƚ����Ͻ�,�ټ�������������Һ,�ⶨ�ռ�����ˮ�����ȷ�����������������
(2)����ˮ���ռ�����,ʵ����ͨ���ⶨ���������������
(3)���������������������Ͻ���Al������,��������Ͻ���Al������������
����ˮ���ռ�����,ʵ����ͨ���ⶨ�������������,���ݼ���ȷ���Ͻ���Al����������,
(1)�ռ���������,����ҩƷǰ�ȼ���װ�õ�������,Ȼ����Ƚ����Ͻ�,�ټ�������������Һ,�ⶨ�ռ�����ˮ�����ȷ���������������,����ȷ�IJ���˳��Ϊcabd,
����:cabd��
(2)����ˮ���ռ�����,ʵ����ͨ���ⶨ�������������,��A���Լ�Ϊ6mol��l-1NaOH��Һ��
����: 6mol��l-1NaOH��Һ��
(3)ʵ���в����Ʒ������ΪWg,���������ΪaL(��״��),��:
2Al+2NaOH+2H2O�T2NaAlO2+3H2��
54g 3��22.4
m(Al) aL
����m(Al)=54��a/3��22.4=18a/22.4g���ʺϽ���Al����������=18a/22.4w��100%=9a/11.2w��100%��
����: 9a/11.2w��100%��

����Ŀ�����Ų��Ͽ�ѧ�ķ�չ�����������仯����õ���Խ��Խ�㷺��Ӧ�ã�������Ϊ���Ͻ��ά��������Ϊ�������ú�������������V2O5��VOSO4�������Բ�������������Ա����������һ�����ӽ��������շ����¹��գ������ʴ�91.7%���ϡ����ֺ���������ˮ�е��ܽ������±���ʾ��
���� | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
�ܽ��� | ���� | ���� | ���� | ���� |
�ù��յ���Ҫ�������¡�

��ش��������⣺
�������ط�����ã�NH4VO3�ڱ��չ����У����������ļ���ֵ�������꣩���¶ȱ仯��������ͼ��ʾ����NH4VO3�ڷֽ������_________��

A���ȷֽ�ʧȥH2O���ٷֽ�ʧȥNH3 B���ȷֽ�ʧȥNH3���ٷֽ�ʧȥH2O
C��ͬʱ�ֽ�ʧȥH2O��NH3 D��ͬʱ�ֽ�ʧȥH2��N2��H2O