题目内容
【题目】工业上制备丙烯的方法有多种,具体如下(本题丙烯用C3H6表示):
已知t1min时达到平衡状态,测得此时容器中n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为![]() 。
。
①该时间段内的反应速率v(C4H8)= _______mol/(L·min)。(用只含m、V、t1的式子表示)。
②此反应的平衡常数K=______________。
③t1min时再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数_______![]() (填“>”“<”“=”)。
(填“>”“<”“=”)。
【答案】![]() 0.5 >
0.5 >
【解析】
①先计算出v(C3H6),然后根据二者反应时的物质的量关系,计算v(C4H8);
②根据平衡常数K的含义,将各种物质的浓度带入定义式,就得到K的值;
③t1min时再往容器内通入等物质的量的C4H8和C2H4,导致容器内气体的物质的量增大,根据浓度商与K大小判断平衡移动方向分析与![]() 的大小;
的大小;
①平衡时n(C3H6)=nmol,n(C4H8)=mmol,n(C2H4)=2mmol,平衡时C3H6的体积分数为![]() 。则
。则![]() ,解得n=m。从反应开始至平衡,v(C3H6)=
,解得n=m。从反应开始至平衡,v(C3H6)=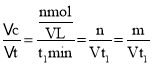 mol/(Lmin),根据方程式可知v(C4H8)=
mol/(Lmin),根据方程式可知v(C4H8)=![]() v(C3H6)=
v(C3H6)=![]() mol/(Lmin);
mol/(Lmin);
②该反应是反应前后气体体积相等的反应,所以它们的浓度比等于二者的物质的量的比,则此反应的平衡常数K=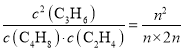 =0.5;
=0.5;
③t1min时达到平衡,此时n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为![]() ,通过前面①的计算可知m=n,现在再往容器内通入等物质的量的C4H8和C2H4,使容器内气体压强增大,假设C4H8改变量为x,根据反应列“三段式”:
,通过前面①的计算可知m=n,现在再往容器内通入等物质的量的C4H8和C2H4,使容器内气体压强增大,假设C4H8改变量为x,根据反应列“三段式”:
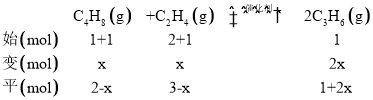
由于反应是等体积的反应,所以浓度比等于物质的量的比,平衡常数表达式用物质的量数值带入,结果不变。假设C3H6的含量不变,仍然为![]() ,则
,则![]() ,解得x=
,解得x=![]() ,则Qc=
,则Qc=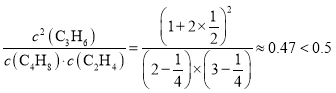 ,说明再往容器内通入等物质的量的C4H8和C2H4,化学平衡向正反应方向移动,因此再达到新平衡时C3H6的体积分数>
,说明再往容器内通入等物质的量的C4H8和C2H4,化学平衡向正反应方向移动,因此再达到新平衡时C3H6的体积分数>![]() 。
。

 阅读快车系列答案
阅读快车系列答案