题目内容
20.完全燃烧2mol某有机物,可以收集到标准状况下89.6L的CO2和6mol的H2O,同时消耗6molO2,试推断该有机物的分子式是( )| A. | C2H4 | B. | C2H4O | C. | C2H6 | D. | C2H6O |
分析 先计算出二氧化碳的物质的量,再根据C、H原子守恒确定有机物分子中C、H原子数目,最后结合耗氧量确定有机物分子中O原子数目.
解答 解:标况下89.6L二氧化碳的物质的量为:$\frac{89.6L}{22.4L/mol}$=4mol,
完全燃烧2mol某有机物,生成4molCO2和6mol H2O,同时消耗6mol O2,
则有机物分子中C原子数目=$\frac{4mol}{2mol}$=2、H原子数目=$\frac{6mol×2}{2mol}$=6,
设有机物分子式为C2H6On,根据耗氧量,则:2mol×(2+$\frac{6}{4}$-$\frac{n}{2}$)=6,解得n=1,
故该有机物的分子式为C2H6O,
故选D.
点评 本题考查有机物分子式确定,题目难度中等,注意掌握质量守恒定律在确定有机物分子式中的应用方法,注意利用通式理解烃及含氧衍生物的耗氧量.

练习册系列答案
相关题目
20.下列实验装置及描述正确的是( )
| A. |  该图装置不能这么碳酸与苯酚的酸性强弱 | |
| B. | 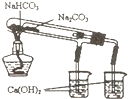 该图可验证NaHCO3和Na2CO3的热稳定性 | |
| C. | 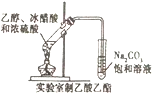 实验室可用该装置制取少量的乙酸乙酯 | |
| D. | 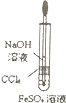 该图装置可用于制备Fe(OH)2 |
11.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下,78g Na202中含有的阴离子数为2NA | |
| B. | 常温下,1L 0.1 mol/L NH4NO3溶液中含有的NH4 +数为0.1NA | |
| C. | 标准状况下,22.4 L己烷中含有的共价键的数目为19 NA | |
| D. | 30 g SiO2晶体中含有Si-O键的数目为2 Na |
9.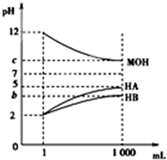 室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1 000mL,其pH的变化与溶液体积的关系如图,下列说法错误的是( )
室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1 000mL,其pH的变化与溶液体积的关系如图,下列说法错误的是( )
 室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1 000mL,其pH的变化与溶液体积的关系如图,下列说法错误的是( )
室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1 000mL,其pH的变化与溶液体积的关系如图,下列说法错误的是( )| A. | HA为强酸,HB为弱酸 | |
| B. | 若b+c=14,则MOH为弱碱 | |
| C. | 若c=9,则稀释后的三种溶液中,由水电离的氢离子的浓度的大小顺序为HA>MOH>HB | |
| D. | 若c=9,将稀释后的HA溶液和MOH溶液取等体积混合,则所得溶液中c(A-)=c(M+) |
10.某有机物A可用于合成药物达菲,其结构简式如图,下列关于A的说法不正确的是( )


| A. | 分子式为C7H6O5 | |
| B. | 和溴水既可以发生取代反应,又可以发生加成反应 | |
| C. | 1 mol该化合物最多可以与含4 mol NaOH的溶液反应 | |
| D. | 既可以和FeCl3溶液发生显色反应,又可以和NaHCO3溶液反应放出CO2气体 |
 .
. 将纯锌片和纯铜片按如图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
将纯锌片和纯铜片按如图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题: