题目内容
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及部分记录)
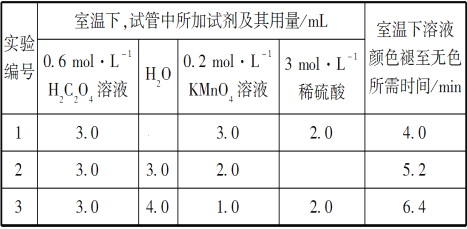
请回答:
(1)根据上表中的实验数据,可以得到的结论是__________________________。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=________。
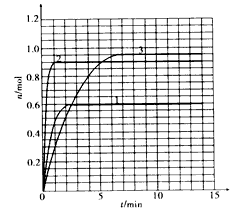
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
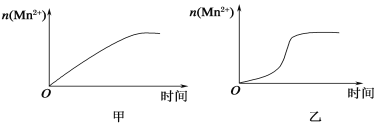
①该小组同学提出的假设是__________________________。
②请你帮助该小组同学完成实验方案,并填写表所加固体的化学式_______。
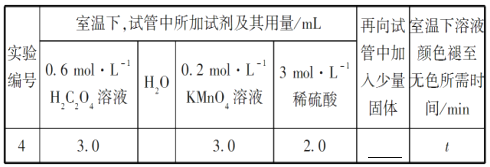
③若该小组同学提出的假设成立,t的大小范围是__________________________。
【答案】其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大1.5×10-2 mol·L-1·min-1生成物中的MnSO4为该反应的催化剂[或Mn2+对该反应有催化作用]MnSO4(t)小于4 min]
【解析】
本题主要结合实验考查了影响反应速率的因素,注意掌握温度、浓度、催化剂对反应速率的影响,解题的关键是对比分析图表中的数据找出相同点和不同点,然后得出结论。
(1)从表中数据可以改变的条件是高锰酸钾溶液的浓度,其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大。(2)草酸的物质的量为0.6×0.003=0.0018mol,高锰酸钾的物质的量为0.2×0.003=0.0006mol,草酸和高锰酸钾的物质的量比为0.0018:0.0006=3:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为0.2×0.003/(3+2+3+2)=0.06mol/L,这段时间内平均反应速率为0.06/4= 1.5×10-2 mol·L-1·min-1。 (3) ①由图乙可知反应开始后速率增大的比较快,说明生成物中的硫酸锰为该反应的催化剂或Mn2+对该反应有催化作用。②与实验1对比实验,则加入的硫酸锰的量不同,其他条件必须相同,所以加入的少量固体为硫酸锰。③若该小组同学提出的假设成立,则反应速率加快,溶液的褪色时间小于4 min。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案