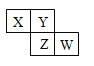题目内容
【题目】电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液滴定10.00 mL浓度均为0.100 mol·L-1 的盐酸和 CH3COOH溶液。利用传感器测得滴定过程中溶液 的电导率如图所示。下列说法不正确的是
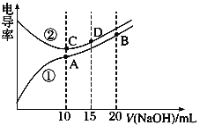
A. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)= 0.0500 mol·L-1
B. 曲线②代表滴定CH3COOH溶液的曲线
C. 在相同温度下,A、B、C三点溶液中水的电离程度: A>C>B
D. B点溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
【答案】B
【解析】
A.A点溶液中醋酸和NaOH恰好完全反应生成醋酸钠和水,溶液体积增大一倍,溶液浓度降为原来的一半,溶液中存在电荷守恒c(CH3COO-)+c(OH-)-c(H+)=c(Na+)=0.05mol/L,选项A正确;B.电解质溶液的电导率越大,导电能力越强,离子浓度越大,醋酸和盐酸的浓度相等,但c(H+)盐酸大于醋酸,未加NaOH溶液时盐酸电导率大于醋酸,所以曲线①代表滴定CH3COOH溶液的曲线,选项B不正确;C.相同温度下,酸或碱抑制水电离,含有弱离子的盐促进水电离,且酸中氢离子浓度或碱中氢氧根离子浓度越大,其抑制水电离程度越大,A中溶质为醋酸钠、B中溶质为物质的量浓度相等的醋酸钠和NaOH、C点溶质为氯化钠,A点促进水电离、B点抑制水电离、C点不影响水电离,所以A、B、C三点溶液中水电离的c(H+):B<C<A,选项C正确;D.B点溶液中溶质为等物质的量浓度的NaOH和CH3COONa,NaOH完全电离,醋酸根离子部分水解,溶液呈碱性,所以离子浓度大小顺序是c(Na+)>c(OH-)>c(CH3COO-)>c(H+),选项D正确;答案选B。

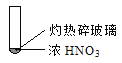
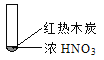
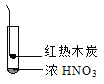
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸发生了反应
C. ③的气体产物中检测出CO2,说明木炭一定与浓硝酸发生了反应
D. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物