题目内容
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下气体的体积为(设反应中HNO3被还原成NO)( )
| A.0.448L | B.0.672L | C.0.896L | D.0.224L |
B
解析试题分析:H2SO4能提供H+,应根据离子方程式进行计算,3Fe+8H++2NO3?=3Fe2++2NO+4H2O,H+共0.08mol+0.02mol=0.1mol,NO3?共0.2mol,NO3?完全反应,2NO3?~3NO,可得NO为0.03mol,标准状况下的体积为0.672L。
考点:本题考查根据离子方程式进行化学计算。

有9.7 g Cu和Zn的合金与足量的稀HNO3反应,还原产物只有NO气体,其体积在标准状况下为2. 24 L。将溶液稀释为IL,测得溶液的pH=l,此时溶液中NO—3的浓度为
| A.0.3 mol/L | B.0.4 mol/L | C.0.5 mol/L | D.0.6 mol/L |
下列化学用语或模型表示正确的是
A.硝基苯的结构简式: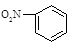 | B.CO2分子比例模型: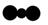 |
C.NH4Cl的电子式: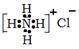 | D.NaCl的晶体模型: |
单质碳和氧化铜在一定温度下反应时,氧化铜可被还原为Cu2O、Cu。现将2.00g C与16.0g CuO的混合物,隔绝空气加热一段时间后,将生成的气体通过足量的澄淸石灰水,共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法错误的是
| A.反应后的固体混合物中还含有碳 |
| B.反应后的固体混合物中Cu的质量为12.8 g |
| C.反应后的固体混合物总质貴为14.4 g |
| D.反应后的固体混合物中氧化物的物质的量为0.05mol |
2008年5月我国汶川发生地震灾害,假若你是卫生防疫人员,为配制0.01 mol/L的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是
| A.取KMnO4样品时不慎在表面沾了点蒸馏水 |
| B.溶解搅拌时有液体飞溅 |
| C.定容时俯视容量瓶刻度线 |
| D.摇匀后见液面下降,再加水至刻度线 |
用NA表示阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,22.4 L H2O中含有的分子数为NA |
| B.28 g N2中含有的分子数为NA |
| C.1 mol Mg与足量稀盐酸反应转移的电子数为NA |
| D.1 L 1 mol·L-1 Na2 CO3溶液中含有的钠离子数为NA |
相对原子质量原来以16O原子质量的十六分之一为标准,现在以12C原子质量的十二分之一为标准,二者相差0.0043%。这两种标准中数值相同的是
| A.14N的质量数 | B.氕原子的相对质量 |
| C.氯元素的相对原子质量 | D.氟化钠的摩尔质量 |
向Cu和Cu2O的混合物27.2g中加入某浓度的硝酸0.1L,固体物质完全反应,生成NO2、 N2O4、NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,溶液恰好呈中性,金属离子也已完全沉淀,沉淀质量为39.2g。以下所得结论不合理的是
| A.硝酸的物质的量浓度为12.0mol/L |
| B.产生的气体在标准状况下的体积为13.44L |
| C.Cu与Cu2O 的物质的量之比为2:1 |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |