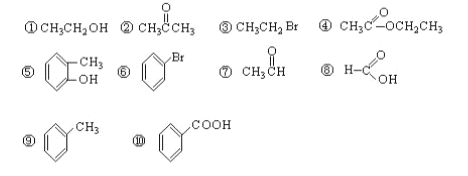
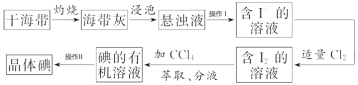
题目内容
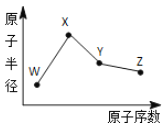
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W 一种核素的质量数为 18,中子数为 10;X 和 Ne 的核外电子数相差1;在Z所在的周期中,Z元素的原子得电子能力最强;四种元素的最外层电子数之和为18。 请回答下列问题:
(1)X元素位于元素周期表中位置为_____________。
(2)X的单质和 Y 的单质相比,熔点较高的是____________(写化学式) 。Z所在族的简单氢化物中,沸点最高的是________(写化学式),原因为______________________。
(3)W、X、Z三种元素形成的化合物中化学键类型为_______;X2W2的电子式为_______。
(4)Z的氧化物很多,其中一种黄绿色气体 M,其氧含量为 47.41%,可用于水处理, M 在液态和浓缩气态时具有爆炸性 。 M 的化学式为___________。M可与NaOH溶液反应生成两种稳定的盐,它们的物质的量之比为 1︰5,该反应的化学方程式为___________。
【答案】第三周期第IA族 Si HF HF分子间能形成氢键 离子键、共价键 ![]() ClO2 6ClO2+6NaOH=NaCl+5NaClO3+3H2O
ClO2 6ClO2+6NaOH=NaCl+5NaClO3+3H2O
【解析】
W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,可知W的质子数为8,则W是氧元素;X和Ne原子的核外电子数相差1,且原子半径比W大,可知X为11号元素,故X为Na元素;在Z所在的周期中,Z元素的原子得电子能力最强,则Z是Cl元素,Y的原子半径介于X和Z之间,四种元素的最外层电子数之和为18,则Y是Si元素,以此解答该题。
根据上述分析可知W是O,X是Na,Y是Si,Z是Cl元素。
(1)X是Na元素,核外电子排布是2、8、1,可知Na元素位于元素周期表中位置为第三周期第IA族;
(2)X是Na,属于金属晶体,Na+与自由电子之间通过金属键结合,Y是Si,属于原子晶体,原子间通过共价键结合,共价键是一种强烈的相互作用,比金属键作用强,因此Na的单质和Si的单质相比,熔点较高的是Si单质;Z是Cl元素,位于第VIIA,在该族的简单氢化物中,由于HF分子之间除存在分子间作用力外,还存在氢键,增加了分子之间的吸引力,使物质的熔沸点升高,故第VIIA元素形成的氢化物中,沸点最高的是HF;
(3)W、X、Z三种元素形成的化合物如NaClO中化学键类型为离子键、共价键;化合物X2W2是Na2O2,该物质是含有非极性共价键的离子化合物,其的电子式为![]() ;
;
(4)M中Cl、O原子个数比为![]() :
:![]() =1:2,所以化学式为ClO2,在ClO2中Cl元素的化合价为+4价,M可与NaOH溶液发生氧化还原反应生成两种稳定的盐,它们的物质的量之比为 1︰5,根据化合价升降代数和等于0,可得该反应的化学方程式为6ClO2+6NaOH=NaCl+5NaClO3+3H2O。
=1:2,所以化学式为ClO2,在ClO2中Cl元素的化合价为+4价,M可与NaOH溶液发生氧化还原反应生成两种稳定的盐,它们的物质的量之比为 1︰5,根据化合价升降代数和等于0,可得该反应的化学方程式为6ClO2+6NaOH=NaCl+5NaClO3+3H2O。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案【题目】如图是元素周期表的一部分,请回答下列问题:
IA | IIA | IIIA | IVA | VA | VI A | VII A | 0 族 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质最不活泼的是___________(填元素符号);
(2)③的气态氢化物的电子式________,②与④形成的气态化合物的结构式_________;
(3)这些元素形成的最高价氧化物的水化物中,碱性最强化合物的电子式:__________; 酸性最强的含氧酸为__________(填物质的化学式);
(4)②的单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式_______;
(5)⑥的单质和⑤的最高价氧化物对应的水化物反应的离子方程式为_________。