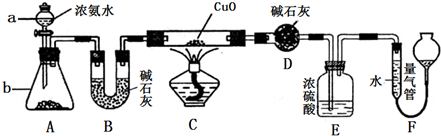
题目内容
下列实验方案能达到预期目的是( )
①实验室保存FeCl3溶液应加少量稀盐酸,并且放入少量的Fe粉
②氢氧化钠溶液保存在配有橡胶塞的细口瓶中
③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO42-
④用焰色反应可以鉴别NaCl溶液与K2CO3溶液
⑤工业上可用金属铝与V2O5在高温下冶炼矾,铝作还原剂.
①实验室保存FeCl3溶液应加少量稀盐酸,并且放入少量的Fe粉
②氢氧化钠溶液保存在配有橡胶塞的细口瓶中
③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO42-
④用焰色反应可以鉴别NaCl溶液与K2CO3溶液
⑤工业上可用金属铝与V2O5在高温下冶炼矾,铝作还原剂.
| A.①②④ | B.①②⑤ | C.②③④ | D.②④⑤ |
①FeCl3与Fe发生氧化还原反应而变质,不能加入铁粉,加入盐酸克防止水解,故①错误;
②氢氧化钠易与玻璃种二氧化硅反应而导致玻璃塞打不开,应用橡胶塞,故②正确;
③加入氯化钡可能生成AgCl沉淀,不能说明溶液中一定含有SO42-,应先加盐酸,如无现象,再加氯化钡检验,故③错误;
④K元素和Na元素的焰色反应现象不同,可鉴别,故④正确;
⑤铝比钒活泼,可置换出钒,用铝热反应可冶炼,故⑤正确.
故选D.
②氢氧化钠易与玻璃种二氧化硅反应而导致玻璃塞打不开,应用橡胶塞,故②正确;
③加入氯化钡可能生成AgCl沉淀,不能说明溶液中一定含有SO42-,应先加盐酸,如无现象,再加氯化钡检验,故③错误;
④K元素和Na元素的焰色反应现象不同,可鉴别,故④正确;
⑤铝比钒活泼,可置换出钒,用铝热反应可冶炼,故⑤正确.
故选D.

练习册系列答案
相关题目

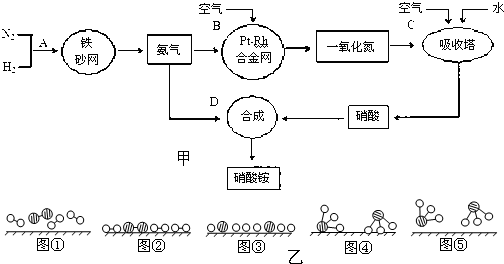
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______、______.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______、______.