题目内容
【题目】实验室用浓硫酸和乙醇反应制备乙烯,若温度过高或加热时间过长,制得的乙烯中往往混有CO2、SO2、H2O (气体少量)。请回答下列问题:
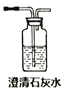
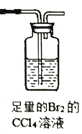
(1)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2、SO2、H2O(g)和乙烯,按气流的方向,各装置的连接顺序是:___________________。
(已知:SO2不能使Br2的CC14 溶液褪色)
① | ② | ③ | ④ | ⑤ |
|
|
|
|
|
(2)能说明有SO2的现象是_______。能说明有CO2的现象是____________。
(3)装置②中所加的试剂是___________,简述确定装置②在整套装置中的位置的理由是____。
(4)装置①的B中的酸性高锰酸钾溶液发生的炉子方程式为:_________。
(5)工业上用乙烯和水制取乙醇,该反应的类型为______反应。写出HCOOH和CH3CH218OH在浓硫酸作用下发生的化学方程式:___________________。
【答案】 ④→②→⑤→①→③ A中的品红溶液褪色 C中的品红溶液不褪色时,澄清石灰水变浑浊 无水CuSO4 若先通入其他装置会带出水蒸气,影响生成的水的检验,所以先检验水 5SO2+3MnO4-+2H2O=5SO42-+2Mn2++4H+ 加成 HCOOH+CH3CH218OH![]() HCO18OCH2CH3+H2O
HCO18OCH2CH3+H2O
【解析】(1)二氧化硫是否存在可用品红溶液检验,检验二氧化碳可以用澄清石灰水溶液。检验水用无水硫酸铜;应先检验水蒸气的存在,因为在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气;由于SO2不能使Br2的CC14 溶液褪色,因此接下来检验乙烯。二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,所以不能先通过澄清的石灰水来检验二氧化碳的存在,二氧化碳的检验应放在排除SO2的干扰后进行,通过品红溶液褪色检验SO2的存在;再通过酸性高锰酸钾溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用澄清石灰水实验检验二氧化碳,即连接顺序为④→②→⑤→①→③;(2)二氧化硫是否存在可用品红溶液检验,因此能说明有SO2的现象是A中的品红溶液褪色;根据以上分析可知能说明有CO2的现象是C中的品红溶液不褪色时,澄清石灰水变浑浊;(3)检验水用无水硫酸铜,由于验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气,应最先用用无水硫酸铜检验水;(4)装置①的B中的酸性高锰酸钾溶液发生的方程式为5SO2+3MnO4-+2H2O=5SO42-+2Mn2++4H+。(5)工业上用乙烯和水加成制取乙醇,该反应的类型为加成反应。酯化反应中羧酸提供羟基,醇通过氢原子,则HCOOH和CH3CH218OH在浓硫酸作用下发生的化学方程式为HCOOH+CH3CH218OH![]() HCO18OCH2CH3+H2O。
HCO18OCH2CH3+H2O。

【题目】在固定容积为2L的密闭容器中,800℃时,发生反应2NO(g)+O2(g)![]() 2NO2(g), n(NO)随时间的变化如下表:
2NO2(g), n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
N(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
下列说法错误的是
A. 若使用合适的正催化剂反应到达平衡的时间少于3s
B. 0 ~2 s内O2的平均反应速率为0.003mol/(L·s)
C. 反应到第5s时,NO的转化率为65%
D. 3s后气体的颜色不再发生改变