题目内容
【题目】(1)氟化氢水溶液中存在的氢键有 种;分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为 ,1个分子中含有 个![]() 键;
键;
(2)金属镍及其化合物在合金材料以及催化剂等方面应用广泛,NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数均为 ;很多不饱和有机物在Ni催化下可以H2发生加成反应,如①CH2=CH2、②HC≡CH、③![]() 、④HCHO等,其中碳原子不是采取sp2杂化的分子有 (填物质编号),HCHO分子的立体构型为 。
、④HCHO等,其中碳原子不是采取sp2杂化的分子有 (填物质编号),HCHO分子的立体构型为 。
【答案】(1)4 N≡C—C≡N 4 (2)6 ② 平面三角形
【解析】
试题分析:(1)氟化氢水溶液中存在的氢键有HF分子之间的氢键;水分子之间的氢键、水分子的H原子与HF分子的F原子之间的氢键和HF分子的H原子与水分子的O原子之间形成的氢键,因此共有4种氢键;分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,因此其结构式为N≡C—C≡N,三键含有2个![]() 键,因此1个分子中含有4个
键,因此1个分子中含有4个![]() 键;
键;
(2)NiO的晶体结构类型与氯化钠的相同,因此NiO晶胞中Ni和O的配位数均为6。①CH2=CH2中碳原子是sp2杂化;②HC≡CH是sp杂化;③![]() 中是碳原子是sp2杂化;④HCHO中碳原子是sp2杂化,其中碳原子没有采取sp2杂化的分子有②,HCHO分子的立体构型为平面三角形。
中是碳原子是sp2杂化;④HCHO中碳原子是sp2杂化,其中碳原子没有采取sp2杂化的分子有②,HCHO分子的立体构型为平面三角形。

 课时训练江苏人民出版社系列答案
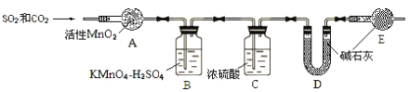
课时训练江苏人民出版社系列答案【题目】实验室用浓硫酸和乙醇反应制备乙烯,若温度过高或加热时间过长,制得的乙烯中往往混有CO2、SO2、H2O (气体少量)。请回答下列问题:
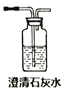
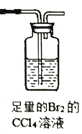
(1)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2、SO2、H2O(g)和乙烯,按气流的方向,各装置的连接顺序是:___________________。
(已知:SO2不能使Br2的CC14 溶液褪色)
① | ② | ③ | ④ | ⑤ |
|
|
|
|
|
(2)能说明有SO2的现象是_______。能说明有CO2的现象是____________。
(3)装置②中所加的试剂是___________,简述确定装置②在整套装置中的位置的理由是____。
(4)装置①的B中的酸性高锰酸钾溶液发生的炉子方程式为:_________。
(5)工业上用乙烯和水制取乙醇,该反应的类型为______反应。写出HCOOH和CH3CH218OH在浓硫酸作用下发生的化学方程式:___________________。
【题目】已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)等物质的量浓度的 A.CH3COONa、B.NaCN、C.Na2CO3、D.NaHCO3溶液的pH由大到小的顺序为____________(填字母)。
(2)常温下, 0.1 mol·L-1的CH3COOH 溶液加水稀释,下列表达式的数据变大的是______。
A.C(H+) B.C(H+)/C(CH3COOH) C.C(H+)·C(OH-)
(3)25 ℃时,将 20 mL 0.1 mol·L-1 CH3COOH 溶液和 20mL0.1 mol·L-1HSCN溶液分别与20mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如右图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是____________; 反应结束后所得两溶液中,(CH3COO-)________c(SCN-)(填“>”、 “<”或“=”)

(4)25 ℃时,在 CH3COOH 与 CH3COONa 的混合溶液中,若测得 pH=6,则溶液中c(CH3COO-)-c(Na+)=__________mol·L-1(填精确值), c(CH3COO-)/c(CH3COOH)=_________。
(5)用离子方程式表示Na2CO3溶液呈碱性的原因_____________________________。