题目内容
将14g铜银合金与足量的一定浓度的硝酸溶液反应,把放出的气体与标准状况下体积为1.12L的O2混合后再通入水中,恰好全部被吸收,则合金中铜的质量为
| A.3.2g | B.4.8g | C.6.4g | D.10.8g |
A
反应中合金失电子,氧气得电子,硝酸最终仍然是硝酸,可认为没有电子的得失
设铜银的物质的量分别为x、y,则64x+108y=14
由电子的得失守恒得:2x+y=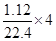
解得:x=0.05mol y=0.1mol
铅的质量为3.2g
设铜银的物质的量分别为x、y,则64x+108y=14
由电子的得失守恒得:2x+y=
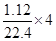
解得:x=0.05mol y=0.1mol
铅的质量为3.2g

练习册系列答案
相关题目
