题目内容
人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”;古代人用青铜(铜锡合金)代替铜制成宝剑,可能的好处是
①熔点低,便于铸造②硬度大,锋利无比③密度小,质量轻④抗腐蚀能力强
①熔点低,便于铸造②硬度大,锋利无比③密度小,质量轻④抗腐蚀能力强
| A.①② | B.①②④ | C.①②③ | D.②③ |
B
从化学角度讲,主要是铜的活泼性差,易于冶炼,还有就是不易腐蚀;另外铜相对来讲,熔点低,便宜于铸造,铜锡合金的硬度大,实用性强,故答案为B

练习册系列答案
相关题目
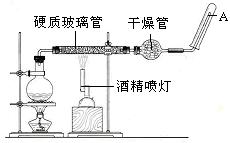
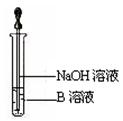
 与用不含O2的蒸馏水配制的NaOH溶液反应制备。
与用不含O2的蒸馏水配制的NaOH溶液反应制备。 。
。 O的质量之比。
O的质量之比。 =5.1,则被还原的硝酸的物质的量为0.1 mol
=5.1,则被还原的硝酸的物质的量为0.1 mol