题目内容
已知25℃,Fe(OH)3(s) Fe3+(aq)+3OH-(aq),Ksp;Fe3++3H2O
Fe3+(aq)+3OH-(aq),Ksp;Fe3++3H2O Fe(OH)3+3H+,Kh;水的离子积常数为Kw。下列Ksp、Kh、Kw的关系是
Fe(OH)3+3H+,Kh;水的离子积常数为Kw。下列Ksp、Kh、Kw的关系是
| A.Ksp·Kh=Kw3 | B.Ksp·Kw=Kh |
| C.Kh/Kw=Ksp | D.Kw/Kh=Ksp3 |
A
解析

练习册系列答案
相关题目
将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
| A.c (Ac-)>c (Cl-)>c (H+)> c (HAc) | B.c (Na+)+c (H+)=c (Ac-)+c (Cl-) |
| C.c (Ac-)=c (Cl-)>c (H+)>c (HAc) | D.c (Ac-)>c (Cl-)>c (HAc)>c(H+) |
室温下,将0.100 0 mol·L-1盐酸滴入20.00 mL 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体 积变化曲线如图所示。下列有关说法不正确的是( )
| A.b点:c(M+)+c(MOH)=c(Clˉ) |
| B.a到b点的水溶液导电性依次增强 |
| C.该一元碱溶液浓度为0.100 0 mol·L-1 |
| D.室温下,MOH的电离常数Kb=1×10-5 |
为了防止热带鱼池中水藻的生长,需保持水中Cu2+的浓度约1.2×10-5 mol·L-1。为避免在每次换池水时溶液浓度的改变,可把适当的含铜化合物放在池底,其饱和溶液提供适当的Cu2+。已知CuS、Cu(OH)2、CuCO3的Ksp值依次为1.3×10-36、2.2×10-20、1.4×10-10,下列四种物质中,能满足池水浓度要求的是( )
| A.CuSO4 | B.CuCO3 | C.Cu(OH)2 | D.CuS |
下列说法中,正确的是
| A.已知25℃时NH4CN水溶液显碱性,则25℃时的电离常数K(NH3·H2O)>K(HCN) |
| B.25℃时,Mg(OH)2固体在20 mL0.01 mol·L-1氨水中的Ksp比在20 mL0.01 mol·L-1NH4Cl溶液中的Ksp小 |
| C.pH试纸测得新制氯水的pH为4.5 |
| D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
H2S水溶液中存在电离平衡H2S H++HS-和HS-
H++HS-和HS- H++S2-。若向H2S溶液中
H++S2-。若向H2S溶液中
| A.滴加新制氯水,溶液pH减小 | B.通入过量SO2气体,溶液pH增大 |
| C.加水,溶液中氢离子浓度增大 | D.加入少量硫酸铜固体,所有离子浓度都减小 |
0.1mol/LHF溶液的pH=2,则该溶液中有关浓度关系式不正确的是
| A.c(H+)>c(F-) | B.c(H+)>c(HF) |
| C.c(HF)>c(OH-) | D.c(HF)>c(F-) |
常温下,0.1 mol·L-1某一元酸HA溶液中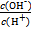 =1×10-12,下列说法中正确的是
=1×10-12,下列说法中正确的是
| A.溶液中由水电离出的c(H+)=1×10-10 mol·L-1 |
B.溶液中存在HA H++A- H++A- |
| C.与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性 |
| D.原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 |