题目内容
室温下,将0.100 0 mol·L-1盐酸滴入20.00 mL 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体 积变化曲线如图所示。下列有关说法不正确的是( )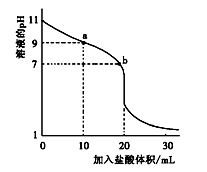
| A.b点:c(M+)+c(MOH)=c(Clˉ) |
| B.a到b点的水溶液导电性依次增强 |
| C.该一元碱溶液浓度为0.100 0 mol·L-1 |
| D.室温下,MOH的电离常数Kb=1×10-5 |
A
解析试题分析:A.b点时溶液为中性,根据电荷守恒可得c(M+)+c(H+)=c(Clˉ)+c(OH-).由于溶液为中性。所以c(H+)=c(OH-)。两式相减可得c(M+)=c(Clˉ)。错误。B.a到b点的水溶液中的电解质由弱电解质变为强电解质,自由移动的离子的浓度逐渐增大,所以导电性依次增强。正确。C.在pH=7时消耗的HCl的体积为20ml,因为在此时酸碱的物质的量相等。所以该一元碱溶液浓度为0.100 0 mol/L.正确。D.室温下,MOH的电离常数Kb=1×10-5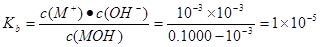 。正确。
。正确。
考点:考查溶液的离子浓度的关系、弱电解质发生酸碱中和时溶液的导电性及电离平衡常数的计算的知识。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在0.1mol·L-1CH3COOH溶液中存在如下电离平衡: CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
| A.加入水时,平衡向生成CH3COOH的方向移动 |
| B.加入少量NaOH固体,平衡向电离的方向移动 |
| C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向电离的方向移动 |
常温下,下列有关物质的量浓度关系正确的是( )
| A.等物质的量浓度的溶液中,水电离出的c(H+):HCl>CH3COOH |
| B.pH相同的溶液中:c(Na2CO3)<c(NaHCO3) |
| C.在Na2SO3溶液中:c(Na+)= 2c(SO32-)+ c(HSO3-)+ c(OH-) |
| D.0.1mol·L-1NaHS溶液中:c(Na+)= c(HS-) |
下列叙述正确的是
| A.Cl2、SO2、NH3的水溶液都能够导电,因此都属于电解质 |
| B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C.100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显碱性 |
| D.常温下,在Fe(OH)3悬浊液中加入足量MgCl2溶液,沉淀由红褐色转化为白色 |
常温下,浓度均为0.1 mol/L 的下列四种盐溶液,其pH测定如下表所示:
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
A.四种溶液中,水的电离程度①>②>④>③
B.Na2CO3和NaHCO3溶液中,粒子种类相同
C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClO
D.Na2CO3溶液中, c(Na+) = c(CO32-)+c(HCO3-)+c(H2CO3)
如图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
| A.两条曲线间任意点均有c(H+)×c(OH-)=Kw |
| B.M区域内任意点均有c(H+)<c(OH-) |
| C.图中T1<T2 |
| D.XZ线上任意点均有pH=7 |
已知25℃,Fe(OH)3(s) Fe3+(aq)+3OH-(aq),Ksp;Fe3++3H2O
Fe3+(aq)+3OH-(aq),Ksp;Fe3++3H2O Fe(OH)3+3H+,Kh;水的离子积常数为Kw。下列Ksp、Kh、Kw的关系是
Fe(OH)3+3H+,Kh;水的离子积常数为Kw。下列Ksp、Kh、Kw的关系是
| A.Ksp·Kh=Kw3 | B.Ksp·Kw=Kh |
| C.Kh/Kw=Ksp | D.Kw/Kh=Ksp3 |
常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
| 实验编号 | c(HA)/mol·L-1 | c(NaOH)/mol·L-1 | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.2 | 0.2 | pH=9 |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
下列判断正确的是
A.a>9
B.在乙组混合液中由水电离出的c(OH-)=10-5mol·L-1
C.c1<0.2
D.丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-)