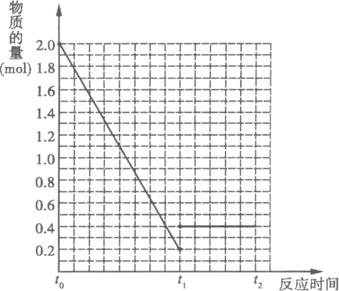
题目内容
将2molSO2和1molO2混合置于容积为2L的密闭容器中,在800K时,发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0,当反应从开始进行到5min时,反应达到平衡状态,测得混合气体总物质的量为2.1mol.请回答下列问题:
(1)800K时,该反应的平衡常数为
(2)若在5min时降低温度,在某一时刻重新达到平衡状态,则新平衡混合物中气体的总物质的量
(3)若相同条件下,向该容器内分别充入xmolSO2、ymolO2和zmolSO3,反应达到平衡时,容器内混合气体总物质的量仍为2.1mol.则:x、y、z必须满足的关系是
(4)相同条件下,若在上述容器中,充入0.2mol SO2、0.4mol O2和4.0molSO3三种气体,下列对该反应状态的描述中,正确的是
A.处于平衡状态 B.不是平衡状态,反应正向进行 C.不是平衡状态,反应逆向进行.
(1)800K时,该反应的平衡常数为
1620
1620
,在0~5min时间间隔内SO2的反应速率为0.18mol/(L?min)
0.18mol/(L?min)
.(2)若在5min时降低温度,在某一时刻重新达到平衡状态,则新平衡混合物中气体的总物质的量
<
<
2.1mol(填“>”、“<”或“=”),简述你的判断理由:正反应是一个气体总物质的量减小的反应,且放热,当降低温度时,平衡向正反应方向移动
正反应是一个气体总物质的量减小的反应,且放热,当降低温度时,平衡向正反应方向移动
.(3)若相同条件下,向该容器内分别充入xmolSO2、ymolO2和zmolSO3,反应达到平衡时,容器内混合气体总物质的量仍为2.1mol.则:x、y、z必须满足的关系是
x+z=2、y+0.5z=1
x+z=2、y+0.5z=1
.(一个用含x、z的式子表示,一个用含y、z的式子表示)(4)相同条件下,若在上述容器中,充入0.2mol SO2、0.4mol O2和4.0molSO3三种气体,下列对该反应状态的描述中,正确的是
C
C
(填字母序号).A.处于平衡状态 B.不是平衡状态,反应正向进行 C.不是平衡状态,反应逆向进行.
分析:(1)令平衡时SO2的浓度变化量为cmol/L,根据三段式表示出平衡时各组分的浓度,再利用平衡后气体的总物质的量计算c值,代入平衡常数表达式k=
计算,再根据v=
计算v(SO2);
(2)正反应是一个气体总物质的量减小的反应,且是放热反应,当降低温度时,平衡向正反应方向移动;
(3)若为等效平衡可以满足,恒温恒容下,反应前后气体的物质的量发生变化,按化学计量数转化为左边,满足n(SO2)=2mol、n(O2)=1mol即可;
(4)计算此时的浓度商Qc,与平衡常数比较,若Qc>k,反应向逆反应进行,若Qc=k,反应处于平衡状态,若Qc<k,反应向正反应进行.
| c2(SO3) |
| c2(SO2)?c(O2) |
| △c |
| △t |
(2)正反应是一个气体总物质的量减小的反应,且是放热反应,当降低温度时,平衡向正反应方向移动;
(3)若为等效平衡可以满足,恒温恒容下,反应前后气体的物质的量发生变化,按化学计量数转化为左边,满足n(SO2)=2mol、n(O2)=1mol即可;
(4)计算此时的浓度商Qc,与平衡常数比较,若Qc>k,反应向逆反应进行,若Qc=k,反应处于平衡状态,若Qc<k,反应向正反应进行.
解答:解:(1)令平衡时SO2的浓度变化量为cmol/L,则:
2SO2(g)+O2(g)?2SO3(g)
开始(mol/L):1 0.5 0
变化(mol/L):c 0.5c c
平衡(mol/L):1-c 0.5-0.5c c
所以(1-c)mol/L×2L+(0.5-0.5c)mol/L×2L+cmol/L×2L=2.1mol
解得:c=0.9
故平衡时SO2、O2、SO3的浓度分别为0.1mol/L、0.05mol/L、0.9mol/L,
故平衡常数k=
=
=1620,
故v(SO2)=
=0.18 mol/(L?min),
故答案为:1620;0.18 mol/(L?min);
(2)正反应是一个气体总物质的量减小的反应,且是放热反应,当降低温度时,平衡向正反应方向移动,达新平衡时,混合气体的总的物质的量减小,
故答案为:<;正反应是一个气体总物质的量减小的反应,且放热,当降低温度时,平衡向正反应方向移动;
(3)恒温恒容下,反应前后气体的物质的量发生变化,按化学计量数转化为左边,满足n(SO2)=2mol、n(O2)=1mol即可,由方程式 2SO2(g)+O2(g)?2SO3(g)可知,zmolSO3完全转化可得SO2为zmol,可得O2为0.5zmol,故满足x+z=2、y+0.5z=1,
故答案为:x+z=2、y+0.5z=1;
(4)充入0.2mol SO2、0.4mol O2和4.0molSO3三种气体,此时浓度商Qc=
=2000>1620,不是平衡状态,反应逆向进行,故选C.
2SO2(g)+O2(g)?2SO3(g)
开始(mol/L):1 0.5 0
变化(mol/L):c 0.5c c
平衡(mol/L):1-c 0.5-0.5c c
所以(1-c)mol/L×2L+(0.5-0.5c)mol/L×2L+cmol/L×2L=2.1mol
解得:c=0.9
故平衡时SO2、O2、SO3的浓度分别为0.1mol/L、0.05mol/L、0.9mol/L,
故平衡常数k=
| c2(SO3) |
| c2(SO2)?c(O2) |
| 0.92 |
| 0.12×0.05 |
故v(SO2)=
| 0.9mol/L |
| 5min |
故答案为:1620;0.18 mol/(L?min);
(2)正反应是一个气体总物质的量减小的反应,且是放热反应,当降低温度时,平衡向正反应方向移动,达新平衡时,混合气体的总的物质的量减小,
故答案为:<;正反应是一个气体总物质的量减小的反应,且放热,当降低温度时,平衡向正反应方向移动;
(3)恒温恒容下,反应前后气体的物质的量发生变化,按化学计量数转化为左边,满足n(SO2)=2mol、n(O2)=1mol即可,由方程式 2SO2(g)+O2(g)?2SO3(g)可知,zmolSO3完全转化可得SO2为zmol,可得O2为0.5zmol,故满足x+z=2、y+0.5z=1,
故答案为:x+z=2、y+0.5z=1;
(4)充入0.2mol SO2、0.4mol O2和4.0molSO3三种气体,此时浓度商Qc=
(
| ||||
(
|
点评:本题考查化学反应速率、影响化学平衡因素、等效平衡、平衡常数的有关计算等问题,难度中等,平衡常数的计算与应用,成为高考的热点,注意平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率等.

练习册系列答案
相关题目
 将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)
将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)