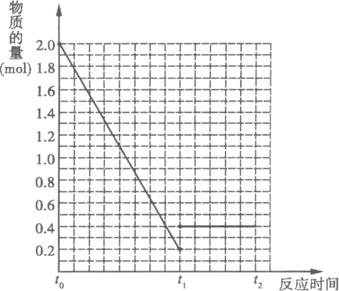
题目内容
 将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)
将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)| 催化剂 |
(1)反应进行到t1时,SO2的体积分数为
(2)若在t1时充入一定量的氩气(Ar),SO2的物质的量将
(3)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量
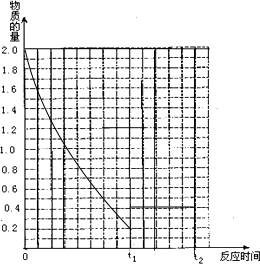
(4)若其它条件不变,在t1时再加入0.2molSO3、0.1molO2和1.8molSO3,在图中作A从t0→t1→t2点这段时间内SO2的物质的量变化曲线.
分析:(1)根据t1点时达到平衡状态,测得混合气体总物质的量为2.1mol,计算出平衡时二氧化硫的物质的量,再计算出SO2的体积分数;
(2)体积可变,压强恒定的密闭容器中充入一定量的氩气(Ar),体积增大,反应物的分压减小,根据压强对平衡的影响分析;
(3)根据温度对平衡的影响分析;
(4)t0到t1时起点在坐标(0,2)、平衡点在坐标(t1,0.2)处;恒压条件下,在t1时再加入0.2molSO2、0.1molO2和1.8molSO3,与原平衡是等效平衡,所以t1到t2 是平行于时间轴的直线,起点必须在(t1,0.4)据此作图.
(2)体积可变,压强恒定的密闭容器中充入一定量的氩气(Ar),体积增大,反应物的分压减小,根据压强对平衡的影响分析;
(3)根据温度对平衡的影响分析;
(4)t0到t1时起点在坐标(0,2)、平衡点在坐标(t1,0.2)处;恒压条件下,在t1时再加入0.2molSO2、0.1molO2和1.8molSO3,与原平衡是等效平衡,所以t1到t2 是平行于时间轴的直线,起点必须在(t1,0.4)据此作图.
解答:解:(1)设参加反应的二氧化硫为nmol,则
2SO2(g)+O2(g)?2SO3(g),
初始量(mol) 2 1
转化量(mol) n
n
平衡量(mol) 2-n 1-
n
已知平衡状态时,测得混合气体总物质的量为2.1mol,即:2-n+1-
+n=2.1mol,解得n=1.8mol,所以t1时,SO2的体积分数为
×100%=9.5%;
故答案为:9.5%;
(2)体积可变,压强恒定的密闭容器中充入一定量的氩气(Ar),体积增大,反应物的分压减小,所以平衡向体积增大的方向移动,即向逆反方向移动,所以SO2的物质的量增大,故答案为:增大;
(3)已知该反应的正方向为放热反应,所以升高温度平衡逆移,逆方向为物质的量增大的方向,所以新平衡混合物中气体的总物质的量>2.1mol,
故答案为:>;升高温度反应向吸热反应方向进行,即化学平衡向逆反应方向移动,气体的总物质的量增大;
(4)t0到t1时起点在坐标(0,2)、平衡点在坐标(t1,0.2)处;恒压条件下,在t1时再加入0.2molSO2、0.1molO2和1.8molSO3,与原平衡是等效平衡,所以t1到t2 是平行于时间轴的直线,起点必须在(t1,0.4),图象为:
故答案为: .
.
2SO2(g)+O2(g)?2SO3(g),
初始量(mol) 2 1
转化量(mol) n
| n |
| 2 |
平衡量(mol) 2-n 1-
| n |
| 2 |
已知平衡状态时,测得混合气体总物质的量为2.1mol,即:2-n+1-
| n |
| 2 |
| 2-1.8 |
| 2.1 |
故答案为:9.5%;
(2)体积可变,压强恒定的密闭容器中充入一定量的氩气(Ar),体积增大,反应物的分压减小,所以平衡向体积增大的方向移动,即向逆反方向移动,所以SO2的物质的量增大,故答案为:增大;
(3)已知该反应的正方向为放热反应,所以升高温度平衡逆移,逆方向为物质的量增大的方向,所以新平衡混合物中气体的总物质的量>2.1mol,
故答案为:>;升高温度反应向吸热反应方向进行,即化学平衡向逆反应方向移动,气体的总物质的量增大;
(4)t0到t1时起点在坐标(0,2)、平衡点在坐标(t1,0.2)处;恒压条件下,在t1时再加入0.2molSO2、0.1molO2和1.8molSO3,与原平衡是等效平衡,所以t1到t2 是平行于时间轴的直线,起点必须在(t1,0.4),图象为:

故答案为:
 .
.点评:本题考查了平衡移动、化学平衡图象等,难度中等,本题作图时要注意对等效平衡的分析.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目