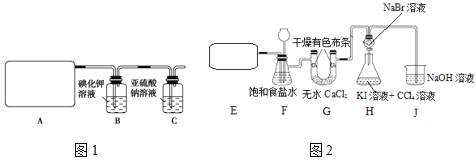
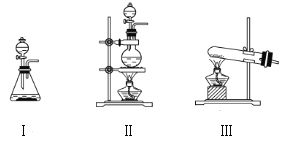
题目内容
【题目】![]() 溶液中存在平衡:
溶液中存在平衡:![]() 橙色
橙色![]() 黄色
黄色![]() 。用
。用![]() 溶液进行下列实验:
溶液进行下列实验:

结合实验,下列说法不正确的是![]()
![]()
A.![]() 中溶液橙色加深,
中溶液橙色加深,![]() 中溶液变黄
中溶液变黄
B.![]() 中
中![]() 被
被![]() 还原
还原
C.对比![]() 和
和![]() 可知
可知![]() 酸性溶液氧化性强
酸性溶液氧化性强
D.若向![]() 中加入
中加入![]() 溶液至过量,溶液变为橙色
溶液至过量,溶液变为橙色
【答案】D
【解析】
K2Cr2O7溶液中加入硫酸,再加入乙醇,颜色发生变化,说明K2Cr2O7与乙醇发生了反应;K2Cr2O7溶液中加入氢氧化钠,再加入乙醇,颜色没有发生变化,说明没有发生反应。
A.①中在平衡体系中加入硫酸,c(H+)增大,平衡逆向移动,Cr2O72-浓度增大,橙色加深,③中在平衡体系中加入NaOH,OH-消耗H+,c(H+)减小,平衡正向移动,溶液变黄,故A正确;
B.②中溶液由橙色变为绿色,乙醇具有还原性,Cr2O72-被乙醇还原,故B正确;
C.②是酸性条件,④是碱性条件,酸性条件下能氧化乙醇,而碱性条件不能,说明酸性条件下K2Cr2O7氧化性强,故C正确;
D.若向④溶液中加入![]() 的硫酸到过量,溶液呈酸性,可以氧化乙醇,溶液变绿色,故D错误;
的硫酸到过量,溶液呈酸性,可以氧化乙醇,溶液变绿色,故D错误;
故选D。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案【题目】某校化学实验课上,老师要求学生用硫酸铜溶液与氢氧化钠溶液制备Cu(OH)2,为了缩短实验时间,老师让学生将反应容器放在沸水浴中进行反应,结果出现了如下两种不同的实验现象:
操作 | 现象 | |
实验一 | 向NaOH溶液中滴加CuSO4溶液 | 黑色沉淀 |
实验二 | 向CuSO4溶液中滴加NaOH溶液 | 蓝色沉淀 |
(1)甲同学认为实验一中产生的黑色沉淀是___(填化学式),理由是___。
(2)为验证推测结果是否正确,甲同学将黑色沉淀过滤、洗涤、干燥后称得质量为ag,并按照如图所示装置进行实验,实验前后称得干燥管E的质量分别为cg和dg。

为确保实验的准确性,甲同学认为应在装置A反应一段时间后再接上装置E,点燃D中的酒精灯,其理由是___。乙同学认为甲同学的装置仍有不足,应在E的末端连接一个气囊,气囊的作用有两个:___。甲同学改进实验装置后完成实验,若a、c、d满足关系式:___,则证明甲同学对黑色沉淀的推测是正确的。
(3)丙同学认为实验二中的蓝色沉淀应为Cu(OH)2,丁同学立即提出反对意见,认为该蓝色沉淀一定不是Cu(OH)2。为确认实验二中蓝色沉淀的成分,丁同学从实验时药品的加入顺序考虑,可能是反应物的用量不同导致产物的不同,并上网查阅资料知,当NaOH溶液少量时会生成碱式硫酸铜[Cu2(OH)2SO4],反应的离子方程式为___。
(4)进一步查阅资料可知碱式硫酸铜为蓝色物质,难溶于水、可溶于酸。请你设计实验,验证实验二中生成的蓝色沉淀含有SO42-:___。
【题目】中学化学中很多“规律”都有适用范围,下列根据有关“规律”推出的结论正确的是( )
选项 | 规律 | 结论 |
A | 元素的非金属性较强,其单质也越活泼 | 磷单质比 |
B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓硝酸、稀硝酸,浓硝酸中铝片先溶解完全 |
C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 |
|
D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加 |
A.AB.BC.CD.D