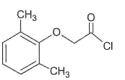
题目内容
【题目】X、Y、Z、W、Q为原子序数依次增大的前四周期元素,X的核外有2个未成对电子,与题述其他元素均能形成二元化合物;Y是地壳中含量最多的金属元素;Z的第一电离能比同周期相邻两种元素的都大;W的外层电子数是最内层电子数的9倍;Q的某种核素的质量数为56,中子数为30。据此回答下列问题:
(1)Q的基态原子的价电子排布式为______________。
(2)题述元素中,电负性最大的是______________(填元素符号),第一电离能介于Y和Z之间的同周期元素有______________(填元素符号)。
(3)Y和W的氯化物中熔点较高的是________(填化学式),原因是_____;与Z的低价氯化物互为等电子体的离子是_______(填一种即可)。
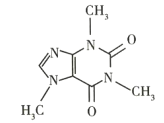
(4)咖啡因对中枢神经有兴奋作用,其结构简式如图所示。常温下,咖啡因在水中的溶解度很小,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是_________。
【答案】3d64s2 O Mg、Si、S CaCl2 CaCl2属于离子晶体,钙离子和氯离子之间离子键作用力强,熔点高,AlCl3属于分子晶体,分子间作用力弱,熔点低 ![]() (或
(或![]() 等) 水杨酸钠易溶于水,咖啡因与水杨酸钠形成了氢键
等) 水杨酸钠易溶于水,咖啡因与水杨酸钠形成了氢键
【解析】
根据题中所给信息,X、Y、Z、W、Q为原子序数依次增大的前四周期元素, Y是地壳中含量最多的金属元素,则Y是Al元素,Z的第一电离能比同周期相邻两种元素的都大,则Z是P元素,W的外层电子数是最内层电子数的9倍,则W是Ca元素,Q的某种核素的质量数为56,中子数为30,根据质量数=质子数+中子数,Q的质子数为26,又原子序数=质子数,则Q为26号元素Fe,因为X的核外有2个未成对电子,与题述其他元素均能形成二元化合物,则X为O元素,据此分析解答。
(1)Fe的基态原子核外有26个电子,其价电子排布式为3d64s2,故答案为:3d64s2;
(2)在这些元素中,电负性:O>P>Ca>Al>Fe,电负性最大的是O元素,根据同周期元素从左到右第一电离能呈增大趋势,以及ⅡA族的3s2全满状态和VA族3s23p3半满状态的稳定性,可知第一电离能介于Al和P之间的同周期元素有Mg、Si和S,故答案为:O;Mg、Si、S;
(3)Y和W的氯化物分别为AlCl3和CaCl2,由于CaCl2是离子晶体,Ca2+和Cl-之间的离子键作用力强,所以CaCl2的熔点高,而AlCl3是分子晶体,分子间作用力小,所以熔点低;Z的低价氯化物为PCl3,原子数和价电子数分别都相等的互为等电子体,与它互为等电子体的离子为![]() 、
、![]() 等,故答案为:CaCl2;CaCl2属于离子晶体,钙离子和氯离子之间离子键作用力强,熔点高,AlCl3属于分子晶体,分子间作用力弱,熔点低;
等,故答案为:CaCl2;CaCl2属于离子晶体,钙离子和氯离子之间离子键作用力强,熔点高,AlCl3属于分子晶体,分子间作用力弱,熔点低;![]() (或
(或![]() 等);
等);
(4)水杨酸钠易溶于水,且其分子中有羟基,而咖啡因分子中有N、O两种电负性很强的元素,所以这两种分子之间可以形成氢键,使咖啡因溶解度增大,故答案为:水杨酸钠易溶于水,咖啡因与水杨酸钠形成了氢键。

【题目】下表是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
元素 | A | B | C | D | E |
最低化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
A.C、D、E的简单氢化物的稳定性:C>D>E
B.元素A的原子最外层中无自旋状态相同的电子
C.元素B、C之间不可能形成化合物
D.与元素B同周期且在该周期中第一电离能最小的元素的单质能与![]() 发生置换反应
发生置换反应
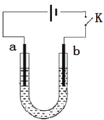
【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法正确的是( )
A.a为石墨,b为铁钉
B.阴极主要发生反应 4OH--4e-== O2↑+ 2H2O
C.高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-== FeO42-+ 4H2O
D.制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体