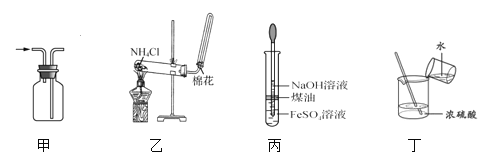
题目内容
【题目】常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为 3.8 ℃,42 ℃以上会分解生成 Cl2 和 O2,Cl2O 易溶于水并与水反应生成 HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比 1∶3 混合通入含水 8%的碳酸钠中制备 Cl2O,并 用水吸收 Cl2O(不含 Cl2)制备次氯酸溶液。

(1)各装置的连接顺序为 → → →C→ 。_____
(2)写出 A 中反应的离子方程式______。
(3)装置 B 中多孔球泡和搅拌棒的作用是_________; 装置 C 的作用是_____。
(4)制备 Cl2O 的化学方程式为_____。
(5)反应过程中,装置 B 需放在冷水中,其目的是_____。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是_____、_____。
(测定浓度)
(7)用下列实验方案测定装置 E 所得溶液中次氯酸的物质的量浓度:
量取 10.00 mL 上述次氯酸溶液,并稀释至 100.00 mL,再从其中取出 10.00 mL 于 锥形瓶中,并加入 10.00 mL 0.8000 mol·L-1 的 FeSO4 溶液(过量),充分反应后,用0.05000 mol·L-1 的酸性 KMnO4 溶液滴定剩余的 Fe2+,消耗 KMnO4 溶液 24.00 mL,则 原次氯酸溶液的浓度为_____。判断下列情况对 HClO 含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”)若 FeSO4 标准溶液部分变质,会使测定结果_____;若配制酸性 KMnO4 溶液 时,定容时俯视刻度线,会使测定结果_________。
【答案】A D B EMnO2 + 4H+ +2Cl- =Mn2++ Cl2 ↑+ 2H2O加快反应速率,使反应充分进行除去 Cl2O 中的 Cl22Cl2+Na2CO3===Cl2O+2NaCl+CO2(或 2Cl2+2Na2CO3+H2O===Cl2O+2NaCl+2NaHCO3)防止反应放热后温度过高导致 Cl2O 分解制得的次氯酸溶液纯度较高浓度较大1.000mol·L-1偏高偏高
【解析】
(1)根据实验目的,要将Cl2和空气混合通入含Na2CO3溶液中制备Cl2O ,应先用装置A制备Cl2,再通过装置D除去混合气体中的HCl气体,同时混入空气,将混合气体通入装置B,在装置B中发生制备Cl2O 的反应;然后将制取的Cl2O气体先通入装置C,以除去Cl2杂质气体,最后通过装置E制取次氯酸溶液,故装置的连接顺序为A、D、B、C、E;综上所述,本题答案是:A、D、B、E。
(2)二氧化锰与浓盐酸加热反应生成氯化锰、氯气和水,反应的离子方程式:MnO2 +4H+ +2Cl- =Mn2++ Cl2↑+ 2H2O;因此本题答案是:MnO2 + 4H+ +2Cl- =Mn2++ Cl2↑+2H2O。
(3)多孔球泡和搅拌棒均能增大反应物的接触面积,加快反应速率,使反应充分进行。氯气属于非极性分子,易溶于非极性的有机溶剂四氯化碳,所以装置 C 的作用是除去 Cl2O 中的Cl2;综上所述,本题答案是:加快反应速率,使反应充分进行; 除去 Cl2O 中的 Cl2。
(4)氯气与碳酸钠溶液发生歧化反应,其中氯元素从0价变为+1价和-1价,生成Cl2O和NaCl,反应的方程式为:2Cl2+Na2CO3===Cl2O+2NaCl+CO2(或 2Cl2+2Na2CO3+H2O===Cl2O+2NaCl+2NaHCO3);因此本题答案是:2Cl2+Na2CO3===Cl2O+2NaCl+CO2(或 2Cl2+2Na2CO3+H2O===Cl2O+2NaCl+2NaHCO3)。
(5)已知Cl2O 在42℃以上会分解生成Cl2和O2,因此反应过程中,装置B需放在冷水中,防止反应放热后温度过高导致Cl2O分解;因此本题答案是:防止反应放热后温度过高导致 Cl2O 分解。
(6)氯气直接溶于水反应生成盐酸和次氯酸的反应为可逆反应,制备的次氯酸浓度较低,并且有盐酸杂质,而用此方法制备次氯酸溶液纯度较高、浓度较大;因此本题答案是:制得的次氯酸溶液纯度较高、浓度较大。
(7)根据反应:H++HClO+2Fe2+=Cl-+2Fe3++H2O可知:HClO--2Fe2+;MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O可知MnO4--5Fe2+,则有关系式:n(Fe2+)=2n(HClO)+5n(MnO4-),带入数据:10×10-3×0.8=2c(HClO)×10×10-3+5×10-3×24×0.05,解得c(HClO)=0.1mol/L,则稀释前的浓度为c(HClO)=0.1×100/10= 1.000mol·L-1;若 FeSO4 标准溶液部分变质,则消耗的高锰酸钾的量减小,根据n(Fe2+)=2n(HClO)+5n(MnO4-)关系可知,n(HClO)的量增大,c(HClO)偏高;若配制酸性 KMnO4 溶液时,定容时俯视刻度线,造成c(KMnO4)偏大,消耗的体积偏小,n(MnO4-)减小,根据n(Fe2+)=2n(HClO)+5n(MnO4-)关系可知,n(HClO)的量偏大,会使测定结果偏大;综上所述,本题答案是:1.000mol·L-1 ;偏高;偏高。

【题目】下列各组物质中,不能满足表中图示物质在一定条件下一步转化关系的组合为
组别 | X | Y | Z | W |
|
A | Al | AlCl3 | Al(OH)3 | Al2O3 | |
B | Na | Na2O2 | Na2CO3 | NaCl | |
C | Fe | FeCl2 | FeCl3 | Fe(OH)3 | |
D | Si | Na2SiO3 | H2SiO3 | SiO2 |
A. A B. B C. C D. D
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为:________________________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL_________mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN 反应产生了白色沉淀 |
步骤2:取_____________________________ | 无明显现象 |
查阅资料:ⅰ.SCN-的化学性质与I-相似 ⅱ.2Cu2++ 4 I-= 2CuI↓+ I2
则Cu2+与SCN-反应的离子方程式为________________________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL 0.1mol/L FeSO4溶液中加入1 mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++ NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_______________________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ__________(填“快”或“慢”)。
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是______________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因__________________________________。
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请从以下提供的实验用品中选择合适的用品,设计实验方案,并画出实验装置图,标明试剂,实现Fe2+![]() Fe3+的转化,同时避免出现此异常现象。
Fe3+的转化,同时避免出现此异常现象。
实验用品:U形管、烧杯、导线、石墨棒若干、铁片若干、盐桥(装有含琼脂的KCl饱和溶液)、 0.1mol/L FeSO4溶液、8mol/L稀硝酸

____________
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:
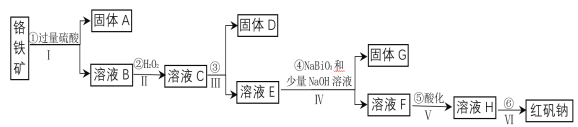
查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-。
ii.
物质 | 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)固体A的成分是____________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和_______ 、______(填仪器名称)。
(3)③为加入物质来调节溶液的pH,则pH的合适范围是_______ 。
(4)写出④反应的离子方程式_____________________________。
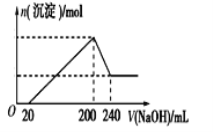
(5)⑤中酸化是使CrO42-转化为Cr2O72-写出该反应的离子方程式_________________。
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。