题目内容
9.下说法正确的是( )| A. | 从海水中提取溴,富集溴可以用亚硫酸钠溶液或二氧化硫水溶液作为吸收液 | |
| B. | 从海水中提取碘常用过氧化氢做还原剂 | |
| C. | 可以用铝热反应制得单质镁 | |
| D. | 铝热剂就是指铝和氧化铁混合物 |
分析 A.亚硫酸钠或二氧化硫水溶液具有还原性,能被溴氧化;
B.碘离子具有还原性,过氧化氢能氧化碘离子而体现氧化性;
C.镁的活泼性大于Al;
D.可以发生铝热反应的混合物称之为铝热剂.
解答 解:A.亚硫酸钠或二氧化硫水溶液具有还原性,能被溴氧化,溴被还原生成溴离子,从而达到富集目的,故A正确;
B.碘离子具有还原性,过氧化氢能氧化碘离子而体现氧化性,所以过氧化氢作氧化剂,故B错误;
C.镁的活泼性大于Al,所以冶炼镁不能采用铝热反应,故C错误;
D.作为铝热剂重要组成的金属氧化物,铝热剂应为Al和过渡元素的氧化物所形成的混合物,故D错误;
故选A.
点评 本题考查海水资源综合利用及铝热反应,为高频考点,侧重考查元素化合物性质,熟悉海水中提取溴的方法及流程,知道金属冶炼方法与金属活动性强弱关系,题目难度不大.

练习册系列答案
相关题目
20.如表为元素周期表前四周期的一部分,下列有关A、B、C、D、E、F六种元素的叙述正确的是( )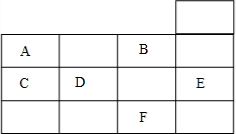

| A. | 常压下六种元素的单质中,F单质的沸点最高 | |
| B. | 晶体E中不存在化学键 | |
| C. | D元素的非金属性比B元素的非金属性强 | |
| D. | 单质A、C均没有同素异形体 |
17.下列反应原理中,不符合工业冶炼金属实际情况的是( )
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | 2Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn | ||
| C. | 2MgO$\frac{\underline{\;电解\;}}{\;}$2Mg+O2↑ | D. | 4CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 |
4.下列说法正确的是( )
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 同一物质固、液、气三种状态的熵值相同 | |
| C. | △H<0、△S>0的反应可自发进行 | |
| D. | 在其他条件不变的情况下,使用催化剂可以改变化学反应进行的方向 |
1.某草药中有一种色素,它的结构简式为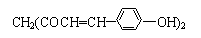 ,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )
,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )
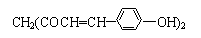 ,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )
,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )| A. | 3 mol、5 mol | B. | 6 mol、8 mol | C. | 10 mol、8 mol | D. | 6 mol、10 mol |
6.含有非极性共价键的物质是( )
| A. | H2 | B. | N2 | C. | SO2 | D. | NH3 |
 .
.
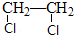 .
.