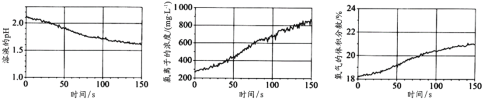
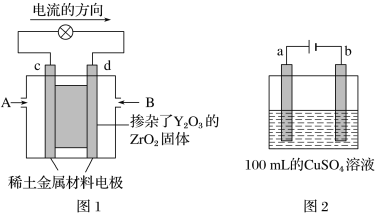
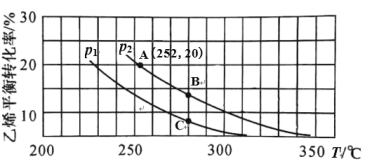
题目内容
【题目】已知X为FeO与CuO的混合物,取两份等质量的X样品进行下列实验:
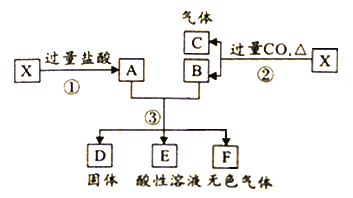
(1)写出步骤③中所有氧化还原反应的化学方程式______________。
(2)设步骤③中所得固体D的质量为32g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6L,试计算取用的每份X的质量为______________,X中FeO与CuO的质量之比为_____________。
【答案】Fe+2HCl=FeCl2+H2 ,CuCl2+ Fe= FeCl2+ Cu 56g 9:5
【解析】
(1)步骤③中,共发生两个氧化还原反应,一个是Fe与Cu2+反应,另一个是Fe与H+反应。
(2)步骤③中所得固体D为Cu,来自两份混合物的转化,质量共为32g,则每份混合物中所含Cu元素的质量为16g,CuO的物质的量![]() 。溶液E中只含有一种金属离子(Fe2+),气体F由过量的Fe与盐酸反应产生,在标准状况下体积为5.6L,物质的量为
。溶液E中只含有一种金属离子(Fe2+),气体F由过量的Fe与盐酸反应产生,在标准状况下体积为5.6L,物质的量为![]() 。先求出每份中所含Fe、Cu原子的物质的量,再求出FeO、CuO的质量。
。先求出每份中所含Fe、Cu原子的物质的量,再求出FeO、CuO的质量。
(1)步骤③中,共发生两个氧化还原反应,化学方程式为:Fe+2HCl=FeCl2+H2↑,CuCl2+ Fe= FeCl2+ Cu。答案为:Fe+2HCl=FeCl2+H2↑,CuCl2+ Fe= FeCl2+ Cu;
(2)步骤③中所得固体D为Cu,来自两份混合物的转化,质量共为32g,则每份混合物中所含Cu元素的质量为16g,CuO的物质的量![]() 。溶液E中只含有一种金属离子(Fe2+),气体F由过量的Fe与盐酸反应产生,在标准状况下体积为5.6L,物质的量为
。溶液E中只含有一种金属离子(Fe2+),气体F由过量的Fe与盐酸反应产生,在标准状况下体积为5.6L,物质的量为![]() 。由CuCl2+ Fe= FeCl2+ Cu,n(Cu)=0.25mol,则参加反应的Fe为0.25mol;由Fe+2HCl=FeCl2+H2↑,n(H2)=0.25mol,可求出Fe为0.25mol。由此可得出CuO为0.25mol,质量为0.25mol×80g/mol=20g;FeO为0.25mol+0.25mol=0.5mol,质量为0.5mol×72g/mol=36g。取用的每份X的质量为36g+20g=56g,X中FeO与CuO的质量之比为36g:20g=9:5。答案为:56g;9:5。
。由CuCl2+ Fe= FeCl2+ Cu,n(Cu)=0.25mol,则参加反应的Fe为0.25mol;由Fe+2HCl=FeCl2+H2↑,n(H2)=0.25mol,可求出Fe为0.25mol。由此可得出CuO为0.25mol,质量为0.25mol×80g/mol=20g;FeO为0.25mol+0.25mol=0.5mol,质量为0.5mol×72g/mol=36g。取用的每份X的质量为36g+20g=56g,X中FeO与CuO的质量之比为36g:20g=9:5。答案为:56g;9:5。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案