题目内容
【题目】用二氧化碳生产化工产品,有利于二氧化碳的大量回收。二氧化碳和乙二醇在ZnO或锌盐催化下可合成碳酸乙烯酯。
CO2+![]()
![]()
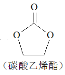 +H2O
+H2O
(1)锌基态原子核外电子排布式为_________;写出一种与CO2互为等电子体的分子的化学式:__________。
(2)锌盐水溶液中Zn2+可与H2O之间形成 [Zn(H2O)6]2+,提供空轨道的是_____(填微粒符号)。
(3)碳酸乙烯酯中碳原子杂化轨道类型为______;1mol碳酸乙烯酯中含有的![]() 键数目为______。
键数目为______。
(4)生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是____________;
②甲醛分子的空间构型是______________(用文字描述);
(5)抗坏血酸的分子结构如图 1 所示,推测抗坏血酸在水中的溶解性:______(填“难溶于水”或“易溶于水”) ;一个Cu2O 晶胞(见图 2)中,Cu 原子的数目为______ 。
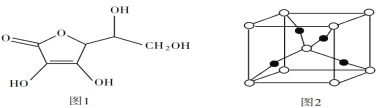
【答案】[Ar]3d104s2或1s22s22p63s23p63d104s2 N2O Zn2+ sp2和sp3 10mol(或10×6.02×1023) 甲醇分子间可形成氢键 平面三角形 易溶于水 4
【解析】
(1)Zn原子核外电子数为30,根据能量最低原理书写核外电子排布式;原子数目和价电子总数相等的微粒互为等电子体;
(2)配离子中中心离子提供空轨道,配体提供孤对电子;
(3)碳酸乙烯酯中酯基中C原子形成3个σ键,没有孤对电子,杂化轨道数目为3,亚甲基中C原子形成4个σ键,没有孤对电子,杂化轨道数目为4;1mol碳酸乙烯酯中含有10mol共价键;
(4)①利用氢键来解释物质的沸点;
②利用杂化类型来分析空间结构;
(5)抗坏血酸中羟基属于亲水基,增大其水解性;依据均摊法计算黑球与白球个数,依据化学式Cu2O判断。
(1)Zn原子核外电子数为30,核外电子排布式为1s22s22p63s23p63d104s2;N2O与CO2的原子数目和价电子数均相等,两者互为等电子体;
(2)Zn2+含有空轨道,H2O含有孤电子对,故Zn2+提供空轨道,H2O提供孤电子对,形成配离子[Zn(H2O)6]2+;
(3)碳酸乙烯酯中酯基中C原子形成3个σ键,没有孤对电子,杂化轨道数目为3,碳原子采取sp2杂化,亚甲基中C原子形成4个σ键,没有孤对电子,杂化轨道数目为4,则碳原子采取sp3杂化;1mol碳酸乙烯酯中含有10mol共价键,含有的σ键数目为:10×6.02×1023=6.02×1024;
(4)①甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高;
②甲醛中碳原子价电子数为3+![]() =3,无孤对电子,则碳原子采取sp2杂化,分子的空间构型为平面三角形;
=3,无孤对电子,则碳原子采取sp2杂化,分子的空间构型为平面三角形;
(5)抗坏血酸中羟基属于亲水基,增大其水解性,所以抗坏血酸易溶于水;该晶胞中白色球个数=8×![]() +1=2、黑色球个数为4,则白色球和黑色球个数之比=2:4=1:2,根据其化学式知,白色球表示O原子、黑色球表示Cu原子,则该晶胞中Cu原子数目为4。
+1=2、黑色球个数为4,则白色球和黑色球个数之比=2:4=1:2,根据其化学式知,白色球表示O原子、黑色球表示Cu原子,则该晶胞中Cu原子数目为4。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案