题目内容
15.已知某温度下,重水D2O的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lg(D+),以下关于pD的叙述正确的是( )| A. | 该温度下纯重水的pD=7 | |
| B. | 在1L D2O的溶液中溶解0.01mol NaOD(设溶液体积为1L),其中pD=12 | |
| C. | 向100mL 0.25mol•L-1的DCl重水溶液中加入50mL 0.2mol•L-1的NaOD的重水溶液,其中pD=2 | |
| D. | 在1L D2O中溶解0.01mol DCl(设溶液的体积为1L),其中pD=2 |
分析 A.某温度下重水D2O的离子积为1.6×10-15,则纯重水中c(D+)=4×10-8mol/L,pD=-lg(D+);
B.在1L D2O的溶液中溶解0.01mol NaOD(设溶液体积为1L),该溶液中c(OD-)=0.01mol/L,c(D+)
=$\frac{1.6×1{0}^{-15}}{0.01}$mol/L=1.6×10-13mol/L;
C.n(DCl)=0.25mol/L×0.1L=0.025mol,n(NaOD)=0.2mol/L×0.05L=0.01mol,则混合溶液中c(D+)
=$\frac{0.025mol-0.01mol}{(0.1+0.05)L}$=0.1mol/L;
D.该溶液中c(D+)=c(DCl)=0.01mol/L.
解答 解:A.某温度下重水D2O的离子积为1.6×10-15,则纯重水中c(D+)=4×10-8mol/L,pD=-lg(D+)=-lg4×10-8=8-lg4=7.4>7,故A错误;
B.在1L D2O的溶液中溶解0.01mol NaOD(设溶液体积为1L),该溶液中c(OD-)=0.01mol/L,c(D+)
=$\frac{1.6×1{0}^{-15}}{0.01}$mol/L=1.6×10-13mol/L,所以pD=13-lg1.6>12,故B错误;
C.n(DCl)=0.25mol/L×0.1L=0.025mol,n(NaOD)=0.2mol/L×0.05L=0.01mol,则混合溶液中c(D+)
=$\frac{0.025mol-0.01mol}{(0.1+0.05)L}$=0.1mol/L,则pD=1,故C错误;
D.该溶液中c(D+)=c(DCl)=0.01mol/L,则pD=2,故D正确;
故选D.
点评 本题以离子积常数为载体考查pH的有关计算,正确计算溶液中c(D+)是解本题关键,采用知识迁移方法计算溶液的pD,注意该温度下离子积常数不是1.0×10-14,为易错点.

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案| A. | Q2 =$\frac{{Q}_{1}}{2}$ | B. | Q2 >$\frac{{Q}_{1}}{2}$ | C. | Q1 =Q2=197 kJ | D. | Q2 <$\frac{{Q}_{1}}{2}$<$\frac{197}{2}$kJ |
| A. | NH4Cl加热分解只生成HCl和NH3,NH4I固体加热分解也只生成HI和NH3 | |
| B. | 第二周期元素氢化物的稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| C. | 足量的CO2气体通入Na2SiO3中可生成NaHCO3; 足量的CO2气体通入石炭酸中也生成了NaHCO3 | |
| D. | 干冰(CO2)是分子晶体,则SiO2也是分子晶体 |
| A. | 将实验室的废酸液和废碱液先进行理后再排放 | |
| B. | 乙烷与氯气制备一氯乙烷 | |
| C. | 以铜和浓硝酸为原料生产硝酸铜 | |
| D. | 加成反应、酯化反应和加聚反应最符合“原子经济性” |
| A. | 常温常压下,11.2L乙烯所含分子数目小于0.5NA | |
| B. | 常温常压下,28g乙烯和丙烯的混合气体中所含碳原子数目小于NA | |
| C. | 乙炔的摩尔质量为26g | |
| D. | 标准状态下,将22.4L乙醇溶于水后配成500mL溶液,所得溶液物质的量浓度为2 mol/L |
| A. | 盐类的水解过程是中和反应的逆过程,是吸热过程 | |
| B. | 易水解的盐溶于水后,都抑制了水的电离 | |
| C. | 易水解的盐溶液中,水电离出的以游离态存在的H+和OH-的浓度永远相等 | |
| D. | 易水解的盐溶液肯定不是中性的 |
| A. | 烷烃同系物随着相对分子质量增大,熔点、沸点逐渐升高;常温下的状态由气态递变到液态,相对分子质量大的则为固态 | |
| B. | 烷烃同系物的密度随着相对分子质量增大逐渐增大 | |
| C. | 烷烃跟卤素单质在光照条件下能发生取代反应,它们燃烧时生成二氧化碳和水 | |
| D. | 烷烃同系物都能使溴水、KMnO4溶液褪色 |
 、⑤ClCH=CHCl⑥
、⑤ClCH=CHCl⑥ 、⑦
、⑦ 、⑧
、⑧ 、⑨
、⑨

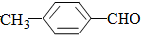
 (或
(或 )
)

 溶解性由大到小的顺序
溶解性由大到小的顺序