题目内容
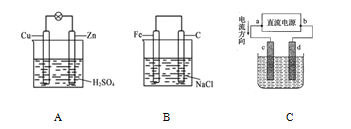
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( )
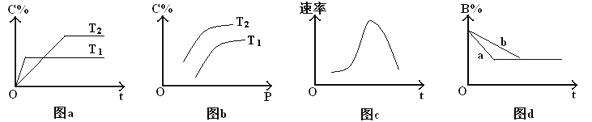
A. 由图a可知,T1>T2,该反应的逆反应为吸热反应
B. 由图b可知,该反应m+n<p
C. 图c是绝热条件下速率和时间的图像,由此说明该反应吸热
D. 图d中,若m+n=p,则曲线a一定增大了压强
【答案】A
【解析】
A. 由图a可知,T1时达到平衡所需时间短,则T1>T2,因温度越高,C%越低,说明升温平衡逆向移动,逆反应为吸热反应,故A正确;
B. 由图b可知,C%随着压强的增大而增大,说明加压后平衡正向移动,正反应为气体分子数目减小的反应,则该反应m+n>p,故B错误;
C.由图c可知,随着反应的时行,反应的速率先增大后减小,说明开始由于反应放热导致温度升高,此时温度对化学反应速率的影响较大,化学反应速率加快,而后由于反应物的浓度减小,体系的温度变化不明显,从而化学反应速率逐渐减小,所以该反应的正反应为放热反应,故C错误;
D. 由图d可知,曲线a较曲线b达到平衡的时间短,反应速率较快,最终的平衡状态是相同的,当m+n=p时,曲线a相对曲线b可能为加压或加入催化剂,故D错误;
答案选A。

 智趣寒假作业云南科技出版社系列答案
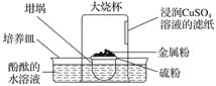
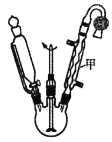
智趣寒假作业云南科技出版社系列答案【题目】乙酰乙酸乙酯在医药上常用于合成维生素B。某化学小组在实验室中用如图装置制备乙酰乙酸乙酯。
已知:ⅰ.2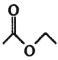
![]()
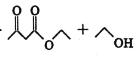
ⅱ.有关物质的性质:
沸点/℃ | 水中溶解性 | |
乙酸乙酯 | 77.2 | 难溶 |
乙酰乙酸乙酯 | 181 | 微溶 |
乙酸 | 118 | 易溶 |
实验步骤:
①向三颈烧瓶中加入9.2g无水乙酸乙酯,迅速加入0.1g切细的金属钠。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。
②向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
③水层用5mL无水乙酸乙酯萃取,分液。
④将①②所得有机层合并,洗涤、干燥、蒸馏得到乙酰乙酸乙酯粗产品。
⑤粗产品纯化得到乙酰乙酸乙酯4.2g。
回答下列问题:
(1)仪器甲的名称是__,水从__(填“上”或“下”)口进入。
(2)步骤②中加入饱和食盐水的作用是__。
(3)步骤④中洗涤时用饱和NaHCO3溶液,目的是__。
(4)步骤⑤中粗产品纯化的操作名称是__。
(5)本实验的产率为__%(结果保留3位有效数字)。