题目内容
12.常温下,pH=3的醋酸溶液和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应.下列说法不正确的是( )| A. | 醋酸的物质的量的浓度为0.1mol•L-1 | |
| B. | 醋酸溶液中由水电离出的:c(H+)=1.0×10-3 mol•L-1 | |
| C. | 反应后的溶液中:c(Na+)>c(CH3OO-)>c(OH-)>c(H+) | |
| D. | 反应后的溶液中:c(CH3COO-)+c(CH3OOH)=0.05mol•L-1 |
分析 常温下,pH=3的醋酸的物质的量浓度是大于0.001mol/L,pH=13的氢氧化钠浓度0.1mol/L,二者等体积混合恰好反应说明醋酸的物质的量和氢氧化钠的物质的量相等,结合物料守恒和电荷守恒分析解答.
解答 解:A、二者等体积混合恰好反应说明醋酸的物质的量和氢氧化钠的物质的量相等,浓度相等,为0.1mol/L,故A正确;
B、常温下,pH=3的醋酸中c(H+)=1.0×10-3 mol•L-1,据水的离子积常数可知,由水电离出来的氢离子浓度为c(H+)=1.0×10-11 mol•L-1,故B错误;
C、醋酸与氢氧化钠恰好中和生成醋酸钠溶液,溶液显碱性,据电荷守恒,c(Na+)>c(CH3OO-)>c(OH-)>c(H+),故C正确;
D、据物料守恒,c(CH3COO-)+c(CH3OOH)=c(Na+)=0.05mol•L-1,故D正确;
故选B.
点评 本题考查了酸碱混合溶液定性判断,根据弱电解质、铵盐的性质结合电荷守恒和物料守恒来分析解答,题目难度不大.

练习册系列答案
相关题目
2.将3.2g铜与过量浓硫酸共热反应,下列叙述中错误的是( )
| A. | 生成的气体体积为1.12 L | |
| B. | 铜片溶解,生成物冷却后倒入盛有水的烧杯中,溶液成蓝色 | |
| C. | 参加反应的硫酸与被还原的硫酸物质的量之比为2:1 | |
| D. | 该实验中可用Na2CO3溶液处理尾气 |
3.常温下,X、Y、Z三种物质的近似pH如图所示.下列说法错误的是( )
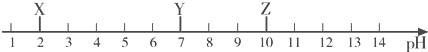

| A. | X一定是稀盐酸 | B. | 酚酞溶液遇Z溶液变红色 | ||
| C. | Y溶液是中性溶液 | D. | X溶液能使石蕊溶液变红 |
20.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 10mL 18mol/L浓硫酸与足量铜加热充分反应,转移电子数为0.18NA | |
| B. | 0.1mol24Mg32S晶体中所含中子总数为2.8NA | |
| C. | 标准状况下,22.4LCO2中含有的共同电子对数为2NA | |
| D. | 6.0g醋酸晶体中含有的H+数为0.1NA |
7.化合物A、B、C、D各由两种元素组成,甲、乙、丙是短周期元素的三种单质.这些常见的化合物与单质之间存在如下关系(已知C是一种有机物),以下结论不正确的是( )
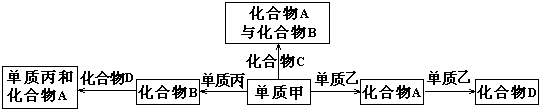

| A. | 常温下,甲、乙、丙三种单质均为气体 | |
| B. | 上述转化关系所涉及的化合物中有一种是电解质 | |
| C. | 上图所示的五个转化关系中,有三个是化合反应 | |
| D. | 上图所示的五个转化关系中,均为氧化还原反应 |
17.1L 0.2mol/L的KI溶液中,含溶质KI的物质的量是( )
| A. | 0.2mol | B. | 0.5mol | C. | 2mol | D. | 5mol |
4.下列行为能减少环境污染的是( )
| A. | 含氮、磷化合物的废水大量排放 | |
| B. | 农业生产中农药、化肥的大量使用 | |
| C. | 实现煤的清洁利用,大力开发新能源 | |
| D. | 使用含有甲醛、氡等的材料装修房子 |
1.下列各组物质无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的量为定值的是( )
| A. | CH2O、C2H4O2、C6H12O6 | B. | CH2=CH2,C2H5OH、HOCH2CH2COOH | ||
| C. | C6H6O、C5H10、C7H6O2 | D. | H2、CO、CH3OH |
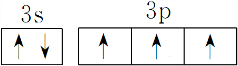 ,能量最高能层符号为M.
,能量最高能层符号为M.