题目内容
2.将3.2g铜与过量浓硫酸共热反应,下列叙述中错误的是( )| A. | 生成的气体体积为1.12 L | |
| B. | 铜片溶解,生成物冷却后倒入盛有水的烧杯中,溶液成蓝色 | |
| C. | 参加反应的硫酸与被还原的硫酸物质的量之比为2:1 | |
| D. | 该实验中可用Na2CO3溶液处理尾气 |
分析 铜与浓硫酸在加热条件下发生:Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O,结合反应的方程式解答该题.
解答 解:铜与浓硫酸在加热条件下发生:Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O,n(Cu)=$\frac{3.2g}{64g/mol}$=0.05mol,
A.由方程式可知产生SO20.05mol,标准状况下的体积为1.12L,但题目没有给出气体存在的条件,故A错误;
B.反应生成CuSO4,生成物冷却后加水稀释溶液成蓝色,故B正确;
C.由方程式可知,参加反应的硫酸与被还原的硫酸物质的量之比为2:1,故C正确;
D.二氧化硫可与碳酸钠溶液反应,则实验中可用Na2CO3溶液处理尾气,故D正确.
故选A.
点评 本题综合考查浓硫酸的性质,为高考常见题型和高频考点,注意浓硫酸的特性,学习中注意相关基础知识的积累,正确书写反应的化学方程式为解答该题的关键,难度不大.

练习册系列答案
相关题目
12.钒是第四周期第VB族元素,V2O5是无臭有毒微溶于水的两性化合物,是一种中等强度的氧化剂.合成V2O5的工业流程图如下:
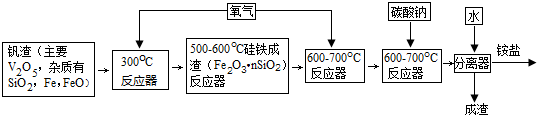
(1)V2O5与氢氧化钠反应的离子方程式:V2O5+6OH-=2VO43-+3H2O.
(2)300℃反应器主要目的是把铁氧化为四氧化三铁.
(3)600-700℃反应器通入氧气的目的是把四氧化三铁氧化为氧化铁.
(4)加入铵盐后,通过过滤、洗涤和干燥得到纯净的“黄饼”(NH4)6V10O28•nH2O.洗涤“黄饼”选用合适的试剂是C.
A.1%的氨水 B.1%的铵盐 C.5%的酒精 D.蒸馏水
(5)①“黄饼”(NH4)6V10O28•nH2O含“结晶水”占质量的20.21%,则n为15.
②对上述“黄饼”133.6g进行热重分析:
写出温度为773K所发生的化学方程式:(NH4)6V10O28•15H2O$\frac{\underline{\;高温\;}}{\;}$6NH3↑+5V2O5+18H2O.

(1)V2O5与氢氧化钠反应的离子方程式:V2O5+6OH-=2VO43-+3H2O.
(2)300℃反应器主要目的是把铁氧化为四氧化三铁.
(3)600-700℃反应器通入氧气的目的是把四氧化三铁氧化为氧化铁.
(4)加入铵盐后,通过过滤、洗涤和干燥得到纯净的“黄饼”(NH4)6V10O28•nH2O.洗涤“黄饼”选用合适的试剂是C.
A.1%的氨水 B.1%的铵盐 C.5%的酒精 D.蒸馏水
(5)①“黄饼”(NH4)6V10O28•nH2O含“结晶水”占质量的20.21%,则n为15.
②对上述“黄饼”133.6g进行热重分析:
| 温度K | 293 | 373 | 773 |
| 质量(g) | 133.6 | 106.6 | 91.0 |
13.下列做法与化学反应速率有关的是( )
| A. | 把块状固体反应物研成粉末 | B. | 使用合适的催化剂 | ||
| C. | 增加反应物的浓度 | D. | 改变反应的温度 |
10.下列对丙酸和甲酸乙酯的说法中,错误的是( )
| A. | 它们互为同分异构体 | B. | 沸点较高的是甲酸乙酯 | ||
| C. | 它们可用红外光谱法鉴别 | D. | 它们可用KMnO4(H+)溶液鉴别 |
17.下列有关物质的性质与应用相对应的是( )
| A. | 浓硫酸具有吸水性,可用于干燥二氧化碳、硫化氢等气体 | |
| B. | 氨气极易溶于水,可用作制冷剂 | |
| C. | 浓硝酸在常温下能使铝钝化,可用铝槽车运输浓硝酸 | |
| D. | SO2具有强还原性,在空气中极易被氧化为SO3 |
7.关于强、弱电解质的有关叙述错误的是( )
| A. | 强电解质在水溶液中完全电离成阴、阳离子 | |
| B. | 在溶液中,导电能力强的电解质是强电解质 | |
| C. | 对同一弱电解质来说,当溶液的温度和浓度不同时,其导电能力也不相同 | |
| D. | 纯净的强电解质在液态时,有的导电,有的不导电 |
14.下列各组物质中属于同分异构体的是( )
| A. | H2O和D2O | B. | 甲醇和二甲醚CH3-O-CH3 | ||
| C. | 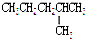 和 和 | D. |  和 和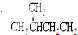 |
11.下列有机物在酸性催化条件下发生水解反应,生成两种不同的有机物,且这两种有机物的相对分子质量相等,该有机物是( )
| A. | 戊酸丁酯 | B. | 葡萄糖 | C. | 丙酸丙酯 | D. | 甲酸乙酯 |
12.常温下,pH=3的醋酸溶液和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应.下列说法不正确的是( )
| A. | 醋酸的物质的量的浓度为0.1mol•L-1 | |
| B. | 醋酸溶液中由水电离出的:c(H+)=1.0×10-3 mol•L-1 | |
| C. | 反应后的溶液中:c(Na+)>c(CH3OO-)>c(OH-)>c(H+) | |
| D. | 反应后的溶液中:c(CH3COO-)+c(CH3OOH)=0.05mol•L-1 |