题目内容
2.现有 aA、bB、CC、dD、eE、gG六种短周期非金属元素,a+b=c,a+c=d,a+d=e,d+e=g,C、E、G的单质圴有在中学常见的两种或多种同素异形体.请回答下列问题:
(1)G基态原子外围电子排布图为
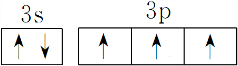 ,能量最高能层符号为M.
,能量最高能层符号为M.(2)C、D、E元素的第一电离能由大到小的关系是N>O>C.(用元素符号表示)
(3)请比较C2A4、D2A4、G2A4三种化合物的沸点由高到低的顺序为N2H4>P2H4>C2H4.原因是均形成分子晶体,N2H4分子间有氢键,P2H4、C2H4的分子间为范德华力,氢键比范德华力更强,故N2H4沸点最高,P2H4的相对分子质量大于C2H4的,P2H4分子间作用力较强,故P2H4的沸点比C2H4的高
(4)C的一种晶体能导电的原因是因为石墨中含有自由电子,通电时自由电子定向移动能导电.
分析 现有 aA、bB、CC、dD、eE、gG六种短周期非金属元素,由a+b=c,a+c=d,a+d=e,d+e=g,可知b、c、d、e之间相差a,而g≤18,故d不能处于第三周期,只能处于第二周期,故B、C、D均为第二周非金属性元素,硼的原子序数最小为5,Ne的原子序数最大为10,则5+2a≤10,则a值最大只能为2,可知E也一定处于第二周期,故5+3a≤10,则a只能为1,可推知A为H元素;C、E、G的单质均有在中学常见的两种或多种同素异形体,则C为碳、E为O,故B为硼、D为N,可知g=7+8=15,故G为P,有红磷、白磷等同素异形体,据此解答.
解答 解:现有 aA、bB、CC、dD、eE、gG六种短周期非金属元素,由a+b=c,a+c=d,a+d=e,d+e=g,可知b、c、d、e之间相差a,而g≤18,故d不能处于第三周期,只能处于第二周期,故B、C、D均为第二周非金属性元素,硼的原子序数最小为5,Ne的原子序数最大为10,则5+2a≤10,则a值最大只能为2,可知E也一定处于第二周期,故5+3a≤10,则a只能为1,可推知A为H元素;C、E、G的单质均有在中学常见的两种或多种同素异形体,则C为碳、E为O,故B为硼、D为N,可知g=7+8=15,故G为P,有红磷、白磷等同素异形体.
(1)G为P元素,基态原子核外电子排布式为:1s22s22p63s23p3,基态原子外围电子排布图为 ,能量最高能层符号为M,
,能量最高能层符号为M,
故答案为: ;M;
;M;
(2)同周期自左而右元素的第一电离能呈增大趋势,但N元素2p能级容纳三个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C,
故答案为:N>O>C;
(3)C2A4、D2A4、G2A4三种化合物分别为C2H4、N2H4、P2H4,均形成分子晶体,N2H4分子间有氢键,P2H4、C2H4的分子间为范德华力,氢键比范德华力更强,故N2H4沸点最高,P2H4的相对分子质量大于C2H4的,P2H4分子间作用力较强,故P2H4的沸点比C2H4的高,则三者沸点由高到低的顺序为:N2H4>P2H4>C2H4,
故答案为:N2H4>P2H4>C2H4;均形成分子晶体,N2H4分子间有氢键,P2H4、C2H4的分子间为范德华力,氢键比范德华力更强,故N2H4沸点最高,P2H4的相对分子质量大于C2H4的,P2H4分子间作用力较强,故P2H4的沸点比C2H4的高;
(4)C的一种晶体石墨可以导电,因为石墨中含有自由电子,通电时自由电子定向移动能导电,
故答案为:因为石墨中含有自由电子,通电时自由电子定向移动能导电.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,需要学生熟练掌握元素周期表的结构,对学生的逻辑推理由一定的要求,题目难度较大.

| A. | 醋酸的物质的量的浓度为0.1mol•L-1 | |
| B. | 醋酸溶液中由水电离出的:c(H+)=1.0×10-3 mol•L-1 | |
| C. | 反应后的溶液中:c(Na+)>c(CH3OO-)>c(OH-)>c(H+) | |
| D. | 反应后的溶液中:c(CH3COO-)+c(CH3OOH)=0.05mol•L-1 |
| A. | 石油主要含烃类物质,这些烃类物质随着烃分子含有的碳原子数的增加沸点升高 | |
| B. | 常压分馏得到的汽油是混合物,没有固定的沸点,但石油气为纯净的丙烷 | |
| C. | 石油分馏不是化学变化,但裂化是化学变化 | |
| D. | 催化重整和加氢裂化可以提高汽油等轻质油的品质 |
| A. | 变化过程中化学键被破坏,则一定发生化学变化 | |
| B. |  实验室制氧气 | |
| C. | Na+、Fe3+-人体所需微量元素 | |
| D. | 能区别地沟油与矿物油的方法是加入足量氢氧化钠溶液共热,不分层的是地沟油 |
(1)某碳酸氢钠样品中含有少量氯化钠,称取该样品,用0.l000mol/L盐酸滴定,耗用盐酸20.00mL.若改用0.05618mol/L硫酸滴定,需用硫酸17.80mL(保留两位小数).
(2)某溶液组成如表一;
表一:
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 814.8 | 400.3 | 97.3 |
表二:
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 137.7 | 428.8 | 97.3 |
(3)将组成如表二的溶液加热,使碳酸氢钠部分分解,溶液中的质量由428.8kg降为400.3kg,补加适量碳酸纳,使溶液组成回刭表一状态.计算补加的碳酸钠质量659.1 kg(保留1位小数).
(4)某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氯化碳,吸收二氯化碳44.8(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg.通过计算确定该晶体的化学式NaHCO3•Na2CO3•2H2O.
| A. | 它是一种含氮的有机化合物 | |
| B. | 它的相对分子质量为126g/mol | |
| C. | 它易溶于苯、四氯化碳等有机溶剂 | |
| D. | 由于它的含氮量高,被不法商人添加到奶粉中,以提升奶粉检测中的蛋白质含量指标 |
| A. | 水果 | B. | 馒头 | C. | 牛奶 | D. | 花生油 |
| A. | 用燃着的木条伸入集气瓶中检验二氧化碳 | |
| B. | 用水区分氢氧化钠固体和氯化钠固体 | |
| C. | 用铁粉除去FeSO4溶液中混有的CuSO4 | |
| D. | 用石灰水除去NaOH溶液中混有的Na2CO3 |
| A. | 两者都为s-sσ键 | B. | 两者都为p-pσ键 | ||
| C. | 前者为p-pσ键,后者为s-pσ键 | D. | 前者为s-sσ键,后者为s-pσ键 |