题目内容
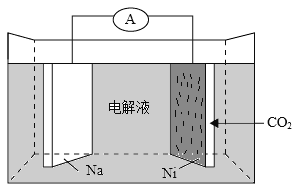
【题目】据图回答下列问题:
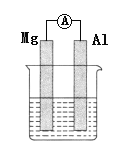
(1)若烧杯中的溶液为稀硫酸,则观察到的现象是___________,负极反应式为___________。
(2)若烧杯中的溶液为氢氧化钠溶液,则正极反应为___________,总反应的化学方程式为___________。
【答案】Mg逐渐溶解,Al片上有气泡冒出,电流计指针偏转 Mg-2e-![]() Mg2+ 6H2O+6e-
Mg2+ 6H2O+6e-![]() 3H2↑+6OH-(或2H2O+2e-
3H2↑+6OH-(或2H2O+2e-![]() H2↑+2OH-) 2Al+2NaOH+2H2O
H2↑+2OH-) 2Al+2NaOH+2H2O![]() 2NaAlO2+3H2↑
2NaAlO2+3H2↑
【解析】
(1)该装置为原电池装置,Mg、Al都能与稀硫酸反应,因为Mg比Al活泼,即Mg为负极,然后进行分析;
(2)Al能与NaOH溶液发生反应,而Mg不与氢氧化钠溶液发生反应,则Al为负极,据此分析;
(1)Mg、Al都能与稀硫酸反应,Mg的金属活泼性强于Al,因此Mg为负极,负极反应式为Mg-2e-=Mg2+,正极反应式为2H++2e-=H2↑,观察到现象是Mg逐渐溶解,Al表面上有气泡冒出,电流指针偏转;
(2)Al能与NaOH溶液中2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Mg不与氢氧化钠溶液发生反应,Al与氢氧化钠溶液发生反应,H2O作氧化剂,即正极反应式为6H2O+6e-=3H2↑+6OH-(或2H2O+2e-![]() H2↑+2OH-)。
H2↑+2OH-)。

【题目】
序列 | 参加反应的物质 | 生成物 | |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4…… | |
② | Cl2、FeBr2 | 只有FeCl3、FeBr3 | |
③ | KClO3、HCl(浓) | Cl2…… |
根据上表中信息判断,下列选项正确的是( )
A.氧化性由强到弱顺序为KClO3>Cl2>Fe3+>Br2
B.第②组反应中Cl2与FeBr2的物质的量之比为1:1
C.第③组反应中生成1molCl2,转移电子2mol
D.第①组反应的其余产物为H2O和O2