题目内容
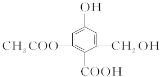
【题目】为测定某烃A的分子组成和结构,对这种烃进行以下实验:①取一定量的该烃,使其完全燃烧后的气体通过装有足量无水氯化钙的干燥管,干燥管增重7.2g;再通过足量石灰水,石灰水增重17.6g。②经测定,该烃(气体)在标准状况下的密度为1.25g·L-1。
I.现以A为主要原料合成某种具有水果香味的有机物,其合成路线如图所示。

(1)A分子中官能团的名称是______,E的结构简式为________。
(2)写出以下反应的化学方程式,并标明反应类型。反应③的化学方程式是__________; G是生活中常见的高分子材料,合成G的化学方程式是________________________;
Ⅱ.某同学用如图所示的实验装置制取少量乙酸乙酯,实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
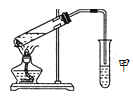
(1)实验开始时,试管甲中的导管不伸入液面下的原因是_______________;当观察到试管甲中________ 现象时认为反应基本完成。
(2)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。
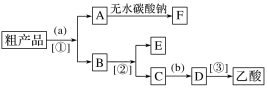
试剂b是____________;分离方法①是__________;分离方法③是________。
(3)在得到的A中加入无水碳酸钠粉末,振荡,目的是________________________________。
【答案】碳碳双键 CH3COOCH2CH3 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应 nCH2=CH2
2CH3CHO+2H2O 氧化反应 nCH2=CH2![]()
![]() 乙酸乙酯中混有的乙酸和乙醇蒸汽易溶于水防倒吸 导气管中不再有油状液体往下滴 稀硫酸 分液 蒸馏 除去乙酸乙酯中的水分
乙酸乙酯中混有的乙酸和乙醇蒸汽易溶于水防倒吸 导气管中不再有油状液体往下滴 稀硫酸 分液 蒸馏 除去乙酸乙酯中的水分
【解析】
I.①取一定量的该烃,使其完全燃烧后的气体通过装有足量无水氯化钙的干燥管,干燥管增重7.2g,即产生水的质量是7.2g,水的物质的量是0.4mol;再通过足量石灰水,石灰水增重17.6g,即产生二氧化碳的质量是17.6g,物质的量是0.4mol,所以该烃的最简式是CH2。②经测定,该烃(气体)在标准状况下的密度为1.25g·L-1,所以相对分子质量是1.25×22.4=28,则A是乙烯。乙烯和水发生加成反应生成B是乙醇,乙醇催化氧化生成C是乙醛,乙醇被酸性高锰酸钾溶液氧化生成D是乙酸,乙醇和乙酸发生酯化反应生成E是乙酸乙酯。乙烯和氯化氢发生加成反应生成F是氯乙烷。
(1)A乙烯分子中官能团的名称是碳碳双键。E是乙酸乙酯,结构简式为CH3COOCH2CH3。
(2)反应③是乙醇的催化氧化,反应的化学方程式是2CH3CH2OH+O2![]() 2CH3CHO+2H2O;G是生活中常见的高分子材料,说明该反应是乙烯的加聚反应,则合成G的化学方程式是nCH2=CH2
2CH3CHO+2H2O;G是生活中常见的高分子材料,说明该反应是乙烯的加聚反应,则合成G的化学方程式是nCH2=CH2![]()
![]() ;
;
Ⅱ.(1)由于生成的乙酸乙酯中混有的乙酸和乙醇蒸汽易溶于饱和碳酸钠溶液,为了防倒吸,因此实验开始时,试管甲中的导管不伸入液面下;由于乙酸乙酯不溶于水,因此当观察到试管甲中导气管中不再有油状液体往下滴现象时认为反应基本完成。
(2)乙酸乙酯中含有乙酸和乙醇,加入饱和碳酸钠溶液分液得到A和B,根据流程图可知A主要是乙酸乙酯,由于其中还含有少量水,则加入无水碳酸钠可以除去除去乙酸乙酯中的水分;B中含有醋酸钠、碳酸钠和乙醇,蒸馏得到乙醇(E),C中含有醋酸钠,加入稀硫酸得到乙酸,然后再蒸馏得到乙酸。
根据以上分析可知试剂b是稀硫酸;分离方法①是分液;分离方法③是蒸馏。
(3)在得到的A中加入无水碳酸钠粉末,振荡,目的是除去乙酸乙酯中的水分。

【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
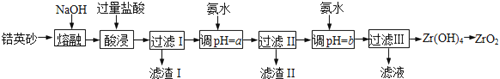
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为 ,滤渣I的化学式为 。
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是 ;继续加氨水至pH=b时,所发生反应的离子方程式为 。
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为 。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是 。