题目内容
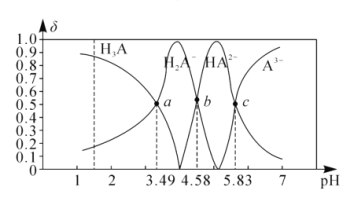
【题目】Ba(NO3)2可用于生产烟花。某主要生产BaCl2、BaCO3、BaSO4的化工厂利用某种钡泥[主要含有BaCO3、Ba(FeO2)2、极少量CuCO3等]制取Ba(NO3)2晶体,其部分工艺流程如下:

已知:Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7。
(1)酸溶时不使用浓硝酸的原因是________。
(2)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为___________。
(3)该厂结合本厂实际,中和选用的X为____________(填化学式);中和使溶液中________(填离子符号)的浓度减少(中和引起的溶液体积变化可忽略)。
(4)滤液得到Ba(NO3)2晶体的操作依次为_____________、_____________、过滤。
(5)为了减少环境污染,请对上述流程中不合理的设计进行改进,改进措施是_______。
【答案】浓HNO3易挥发、分解 Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O BaCO3 Fe3+、H+ 蒸发浓缩 冷却结晶 洗涤废渣并回收洗涤液
【解析】
BaCO3中含有Ba(FeO2)2、极少量CuCO3等,其中Ba(FeO2)2中钡元素为+2价,铁元素为+3价,加入硝酸,在容器中充分溶解得到溶液,此溶液中含有钡离子、铜离子、三价铁离子,可加入X碳酸钡,调节溶液pH=4~5,使铁离子、铜离子水解生成氢氧化铁沉淀、氢氧化铜沉淀,过滤后滤渣为氢氧化铁、氢氧化铜,滤液中主要含有硝酸、硝酸钡,经蒸发浓缩,冷却结晶,过滤得到硝酸晶体,据此分析解答。
BaCO3中含有Ba(FeO2)2、极少量CuCO3等,其中Ba(FeO2)2中钡元素为+2价,铁元素为+3价,加入硝酸,在容器中充分溶解得到溶液,此溶液中含有钡离子、铜离子、三价铁离子,可加入X碳酸钡,调节溶液pH=4~5,使铁离子、铜离子水解生成氢氧化铁沉淀、氢氧化铜沉淀,过滤后滤渣为氢氧化铁、氢氧化铜,滤液中主要含有硝酸、硝酸钡,经蒸发浓缩,冷却结晶,过滤得到硝酸晶体,
(1)浓HNO3易挥发、分解,则酸溶时不宜使用浓硝酸;
故答案为:浓HNO3易挥发、分解;
(2)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应生成硝酸钡、硝酸铁和水,反应的化学方程式为Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O;
故答案为:Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)该厂结合本厂实际,中和选用的X必须能消耗过量的硝酸并使铁离子沉淀而除去,且不引入新杂质,可为BaCO3;中和使溶液中Fe3+、H+的浓度减少;
故答案为:BaCO3;Fe3+、H+;
(4)滤液中主要含有硝酸、硝酸钡,则滤液得到Ba(NO3)2晶体的操作依次为蒸发浓缩,冷却结晶,过滤;
故答案为:蒸发浓缩;冷却结晶;
(5)为了减少环境污染,请对上述流程中不合理的设计进行改进,改进措施是洗涤废渣并回收洗涤液;
故答案为:洗涤废渣并回收洗涤液。