��Ŀ����
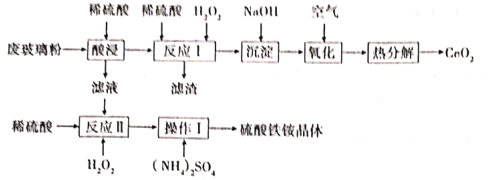
����Ŀ����Ce����һ����Ҫ��ϡ������Ԫ�أ��������ϼ�Ϊ+3��+4���ڹ�ҵ��Ӧ�ù㷺��ij�������Ի��շϾɵĵ�����ʾ���IJ����ۣ���SiO2��CeO2��Fe2O3����FeO�ȣ�Ϊԭ�ϣ������¹������̻���CeO2�������������茶���[Fe2��SO4��32��NH4��2SO43H2O]
��֪����CeO2������ϡ���ᣬҲ������NaOH��Һ�������ʱCeO2����Ӧ���ۡ���ӦI��������Һ�к���Ce3+��
�Իش���������
��1�����������Ļ�ѧʽΪ______��
��2�������������£�H2O2��Fe3+��CeO2���������У���������ǿ����______���罫ϡ�����Ϊ���ᣬ����������̿��ܲ����Ĵ�����Ⱦ����______��
��3������Ӧ�����ӷ���ʽΪ______��
��4������������Ӧ�Ļ�ѧ����ʽΪ______��
��5��������������Ϊ�����������ᾧ�����ˡ�______�������ɵȲ���������������麟�������ˮ������ȥ�����Է�ˮ�е�������ʱЧ�ʽ��ͣ�ԭ����______��
��6����ѧ������CeO2��̫���������½�H2O��CO2ת����H2��CO����������£�mCeO2![]() ��m-x��CeO2xCe+xO2��
��m-x��CeO2xCe+xO2��
��m-x��CeO2xCe+xH2O+xCO![]() mCeO2+xH2+xCO���ڸ���ת�������У�CeO2��______��������ת���ĽǶȣ��ù��̵���Ҫ������______��
mCeO2+xH2+xCO���ڸ���ת�������У�CeO2��______��������ת���ĽǶȣ��ù��̵���Ҫ������______��
���𰸡�SiO2 CeO2 Cl2 2CeO2+H2O2+6H+=2Ce2++O2��+4H2O 4Ce��OH��3+O2+2H2O=4Ce��OH��4 ϴ�� ������ˮ�ⱻ���� ���� ��̫����ת��Ϊ��ѧ��
��������
������ͼ��֪���ϲ�����ĩ����SiO2��Fe2O3��CeO2��FeO�����ʣ��м���ϡ���ᣬFeOת��ΪFeSO4��Fe2O3ת��Fe2��SO4��3��������Һ�У�����ΪCeO2��SiO2����Һ�м���ϡ����������⣬�������ӱ�����Ϊ�����ӣ���ҺΪFe2��SO4��3����������炙������Ũ�����������ɺ�õ�������茶��壻�������������м���ϡ�����H2O2��CeO2ת��ΪCe3+��������Һ�У���ӦΪ2CeO2+H2O2+3H2SO4=Ce2��SO4��3+O2��+4H2O������ΪSiO2����Һ�м�������������Һ������ͨ�����������������Ce��+3����Ϊ+4��4Ce��OH��3ת��Ϊ����Ce��OH��4����ӦΪ��4Ce��OH��3+O2+2H2O�T4Ce��OH��4������ֽ�Ce��OH��4�õ���ƷCeO2��
��1��SiO2��CeO2������ϡ���ᣬ�������������м���ϡ�����H2O2��CeO2ת��ΪCe3+��������Һ�У�����˵õ���������Ϊ�������裬�ʴ�Ϊ��SiO2��
��2�������������£�H2O2��Fe3+��CeO2���������У�CeO2�������ⷢ��������ԭ��Ӧ��������������ԭ���������������������������������������ӣ���������ǿ����CeO2���罫ϡ�����Ϊ���ᣬ����������������ӱ������������������ܲ����Ĵ�����Ⱦ����Cl2���ʴ�Ϊ��CeO2��Cl2��
��3����Ӧ����CeO2ת��ΪCe3+��������Һ�У���ӦΪ2CeO2+H2O2+3H2SO4=Ce2��SO4��3+O2��+4H2O����Ӧ�����ӷ���ʽ��2CeO2+H2O2+6H+=2Ce2++O2��+4H2O���ʴ�Ϊ��2CeO2+H2O2+6H+=2Ce2++O2��
+4H2O��
��4������������Ce��+3����Ϊ+4��4Ce��OH��3ת��Ϊ����Ce��OH��4������������Ӧ�Ļ�ѧ����ʽΪ��4Ce��OH��3+O2+2H2O�T4Ce��OH��4�� �ʴ�Ϊ��4Ce��OH��3+O2+2H2O�T4Ce��OH��4��
��5��������������Ϊ�����������ᾧ�����ˡ�ϴ�ӡ��������ɵȲ���������������麟�������ˮ������ȥ�����Է�ˮ�е�������ʱЧ�ʽ��ͣ�ԭ����������ˮ�ⱻ���ƣ� �ʴ�Ϊ��ϴ�ӣ�������ˮ�ⱻ���ƣ�
��6��ͨ��̫����ʵ���ܷ�ӦH2O+CO2��H2+CO+O2��֪��CeO2û�����ģ�CeO2Ϊ�������ù�������̫���������½�H2O��CO2ת��ΪH2��CO������̫����ת��ɻ�ѧ�ܣ��ʴ�Ϊ����������̫����ת��Ϊ��ѧ�ܡ�

����Ŀ�����ʵ�����ͬ��NaHCO3��KHCO3��������9.20g��0.2mol/L���ᷴӦ��
��1�������״��������CO2�����������Ҫʲô����___�������ۣ�2���������У���������a��ʾ��
a | ����CO2�������L�� |
��2������aֵ�ı仯ʱ������CO2���������״����___