题目内容
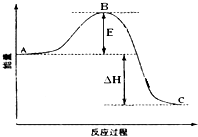
【题目】HBr被O2氧化依次由如下Ⅰ、Ⅱ、Ⅲ、三步反应组成,1molHBr被氧化为Br2放出12.67kJ热量,其能量与反应进程曲线如图所示。
(Ⅰ)HBr(g)+O2(g)==HOOBr(g)
(Ⅱ)HOOBr(g)+ HBr(g)==2HOBr(g)
(Ⅲ)HOBr(g)+ HBr(g)== H2O(g)+ Br2(g)
下列说法正确的是

A. 三步反应均为放热反应
B. 步骤(I)的反应速率最慢
C. HOOBr比HBr和O2稳定
D. 热化学方程式为4HBr(g)+O2(g)==2H2O(g)+2Br2(g) △H=-12.675kJmol-1
【答案】B
【解析】A. 放热反应的反应物总能量高于生成物的总能量,根据图像,第一步反应为吸热反应,故A错误;B. 步骤(I)为吸热反应,导致体系温度降低,反应速率减慢,其余反应为放热反应,反应温度升高,反应速率加快,故B正确;C. HOOBr的总能量比HBr和O2的总能量高,能量越高,物质越不稳定,故C错误;D. 根据题意,1molHBr被氧化为Br2放出12.67kJ热量,则热化学方程式为4HBr(g)+O2(g)==2H2O(g)+2Br2(g) △H=-50.68kJmol-1,故D错误;故选B。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】化学在生活中有着广泛的应用,下列对应关系正确的是()
选项 | 化学性质 | 实际应用 |
A | Al2(SO4)3和苏打Na2CO3溶液反应 | 泡沫灭火器灭火 |
B | 油脂在酸性条件下的水解反应 | 工业生产中制取肥皂 |
C | 醋酸具有酸性 | 食醋除水垢 |
D | SO2具有漂白性 | 可用于食品增白 |
A.AB.BC.CD.D
【题目】下列除杂试剂选择正确的是
选项 | 待提纯物质 | 杂质 | 除杂试剂 |
A | Cl2 | HCl | NaOH溶液 |
B | CO2 | CO | O2 |
C | FeCl3溶液 | FeCl2 | Cl2 |
D | Na2CO3 | NaHCO3 | 盐酸 |
A. A B. B C. C D. D