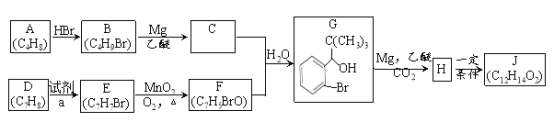
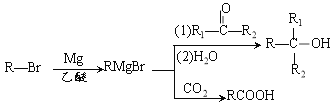
��Ŀ����
����Ŀ�����淴Ӧ2A��g��+3B��g��4C��g��+D��g������֪��ʼŨ��c��A��=4molmol��1 �� c��B��=3molmol��1 �� C��DŨ�Ⱦ�����0����Ӧ��ʼ2���ﵽƽ��״̬����ʱD��ƽ��Ũ��Ϊ0.5molL��1 �� ������˵������ȷ���ǣ�������
A.��Ӧ����v��C��=1molL��1s��1
B.C��ƽ��Ũ��Ϊ4 molL��1
C.A��ת����Ϊ25%
D.B��ƽ��Ũ��Ϊ1.5 molL��1
���𰸡�B
����������������ʽ�����㣺
2A��g��+ | 3B��g�� | 4C��g��+ | D��g�� | |
��ʼ��mol/L�� | 4 | 3 | 0 | 0 |
ת����mol/L�� | 1 | 1.5 | 2 | 0.5 |
ƽ�⣨mol/L�� | 3 | 1.5 | 2 | 0.5 |
A����Ӧ����v��C��= ![]() =1mol/��L��s������A���������⣻
=1mol/��L��s������A���������⣻
B��C��ƽ��ΪŨ��Ϊ2mol/L����B�������⣻
C��A��ת����Ϊ ![]() =25%����C���������⣻
=25%����C���������⣻
D��B��ƽ��Ũ��Ϊ1.5mol/L����D���������⣮
�ʴ�Ϊ��B��
��������ʽ����ƽ�������ʵ����ʵ���Ũ�ȣ�Ȼ����м��㼴��.

 â���̸����������������ϵ�д�
â���̸����������������ϵ�д�����Ŀ����ˮ��һ����Ļ�ѧ��Դ���⣬���ú�ˮ���Ի�úܶ����Ʒ��
��1����ˮ�����ķ���������________________(��1�ַ���)��
��2����ˮ�Ƶõı����Ȼ�����Һ�������õ�ֱⷨ����ȡ�������ƣ���ȡ�����ӷ���ʽΪ___________��
��3���������κ����±��ȡ��Ĺ�����������(���ֲ�������������ȥ):
![]()
��Br2��Na2CO3��Ӧ�Ļ�ѧ����ʽ��������:______________
��Br2+��Na2CO3==��NaBrO3+��_____+��______
��4����±������ȴ������±�����Ҫ�ɷ���MgCl2�������Fe2+��Fe3+��Mn2+�����ӡ���±��Ϊԭ���Ƶ�þ�Ĺ�����������(���ֲ�������������ȥ)��

��֪:������0.010mol/L���������ڲ�ͬpH�µij����������:
���� | ��ʼ���� | ������ȫ |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 |
�ٲ�����������pH=9.8����Ŀ����_________________________��
����NaClO����Fe2+�õ�Fe(OH)3���������ӷ�Ӧ����ʽΪ___________________��
�۲���ۿ��Խ�SOCl2��MgCl2��6H2O��ϼ�����ȡ��ˮMgCl2��SOCl2��������___________��
��NaClO���ܳ�ȥ��±�е�CO(NH2)2�������κ��ܲ������ѭ�������ʡ���ȥ0.2molCO(NH2)2ʱ����NaClO__________g��
���������0.010mol/LMgCl2��Һ�����ݱ����е����ݼ��㣬��pH=11.2ʱ��Һ��c(Mg2+)=____mol/L��
����Ŀ��X��Y��Z��WΪ��ԭ��������С�������е����ֶ�����Ԫ�أ���֪��
��XԪ��ԭ�Ӽ۵����Ų�ʽΪns2np2 �� ��ԭ�Ӱ뾶��ͬ��Ԫ������С�ģ�
��YԪ���ǵؿ��к�������Ԫ�أ�WԪ�صĵ縺����С��YԪ�أ���Wԭ�ӵĵ����Ų��У�p�����ֻ��1��δ�ɶԵ��ӣ�
��ZԪ�صĵ��������ݼ�����kJ/mol����
I1 | I2 | I3 | I4 | �� |
496 | 4562 | 6912 | 9540 | �� |
��ش�
��1��Z2Y2�ĵ���ʽΪ �� ���еĻ�ѧ������ �� Z2Y2Ϊ���壮
��2��X��Y��Z����Ԫ�����γɵij��������������Ϊ��XY2�ĽṹʽΪ �� �������幹��Ϊ ��
��3��X��Y��Z��W����Ԫ�����γɵĵ����У��۵���ߡ�Ӳ���������������ƣ�������ZW���۵�Ⱦ���XW4���Ըߵ�ԭ���� ��