题目内容
(9分)某研究性学习小组利用废铜制取CuSO4:
(1) 甲学生进行了下列实验:取含6.4g铜的废铜和10ml 18ml·L-1浓硫酸放在圆底烧瓶中共热,起到反应完毕,最后发现烧瓶中还有铜片剩余。他根据自己所学的化学知识,认为烧瓶中还有较多的硫酸剩余。你认为他的判断是否正确 ,其理由是:
。
 写出相关的化学方程式: 。
写出相关的化学方程式: 。
(2) 乙同学认为甲设计的实验方案不好,他自己设计的思路是:2Cu+O2==2CuO;CuO+H2SO4
==CuSO4+H2O。对比甲的方案,乙同学的优点是:
。
(3) 丙同学采用向含有废铜屑的热的稀H2SO4中,不断通入空气也能制备CuSO4,请写出相关的化学方程式: 。
(1) 甲学生进行了下列实验:取含6.4g铜的废铜和10ml 18ml·L-1浓硫酸放在圆底烧瓶中共热,起到反应完毕,最后发现烧瓶中还有铜片剩余。他根据自己所学的化学知识,认为烧瓶中还有较多的硫酸剩余。你认为他的判断是否正确 ,其理由是:
。
 写出相关的化学方程式: 。
写出相关的化学方程式: 。(2) 乙同学认为甲设计的实验方案不好,他自己设计的思路是:2Cu+O2==2CuO;CuO+H2SO4
==CuSO4+H2O。对比甲的方案,乙同学的优点是:
。
(3) 丙同学采用向含有废铜屑的热的稀H2SO4中,不断通入空气也能制备CuSO4,请写出相关的化学方程式: 。
(1)是(1分),随着反应的进行硫酸浓度变小,稀硫酸不与铜反应;(2分)
Cu+2H2SO4(浓)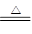 CuSO4+SO2+2H2O(2分)
CuSO4+SO2+2H2O(2分)
(2)硫酸用量少,且没有污染物SO2产生(2分)
(3)2Cu+O2+2H2SO4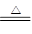 2CuSO4 +2H2O(2分)
2CuSO4 +2H2O(2分)
Cu+2H2SO4(浓)
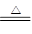 CuSO4+SO2+2H2O(2分)
CuSO4+SO2+2H2O(2分)(2)硫酸用量少,且没有污染物SO2产生(2分)
(3)2Cu+O2+2H2SO4
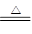 2CuSO4 +2H2O(2分)
2CuSO4 +2H2O(2分)(1)由于只有浓硫酸才能和铜反应。而随着反应的进行硫酸浓度变小,稀硫酸不与铜反应,反应的方程式为Cu+2H2SO4(浓)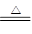 CuSO4+SO2+2H2O。
CuSO4+SO2+2H2O。
(2)浓硫酸直接核铜反应,会产生SO2,污染环境,且硫酸的用量也多。
(3)因为在加热的条件下,氧气能把铜氧化,生成氧化铜,氧化铜核硫酸反应即生成硫酸铜。方程式为2Cu+O2+2H2SO4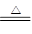 2CuSO4 +2H2O。
2CuSO4 +2H2O。
 CuSO4+SO2+2H2O。
CuSO4+SO2+2H2O。(2)浓硫酸直接核铜反应,会产生SO2,污染环境,且硫酸的用量也多。
(3)因为在加热的条件下,氧气能把铜氧化,生成氧化铜,氧化铜核硫酸反应即生成硫酸铜。方程式为2Cu+O2+2H2SO4
 2CuSO4 +2H2O。
2CuSO4 +2H2O。
练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
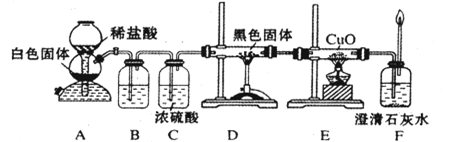
 CO+H2 CO + H2O
CO+H2 CO + H2O 2CO
2CO 
 SiHCl3 + H2(g)
SiHCl3 + H2(g) Si(s)+ 3HCl(g)
Si(s)+ 3HCl(g)