题目内容
9.已知:H2(g)+Br2(g)=2HBr(g)△H=-72kJ/mol,1mol Br2(g)液化放出的能量为30kJ,其它相关数据如下表:则上述表格中的a值为( )| 一定状态的分子 | H2(g) | Br2(l) | HBr(g) |
| 1mol该分子中的化学键断裂吸收的能量/kJ | 436 | a | 369 |
| A. | 404 | B. | 344 | C. | 260 | D. | 200 |
分析 根据盖斯定律计算反应H2(g)+Br2(g)=2HBr(g)的△H,结合反应热等于反应物的总键能减生成物的总键能列方程计算.
解答 解:在H2(g)+Br2(g)=2HBr(g)△H=-72kJ/mol反应中,1mol Br2(g)液化放出的能量为30kJ,即Br2(g)=Br2(l)△H=-30kJ/mol,则H2(g)+Br2(l)=2HBr(g)△H=-42kJ/mol,反应热等于反应物的总键能减生成物的总键能,则-42=436+a-2×369,a=260,
故选C.
点评 本题考查反应热的有关计算、键能与反应热的关系等,题目难度中等,明确△H=反应物的总键能-生成物的总键能是解题的关键,注意反应热与键能的计算关系以及物质的不同聚集状态的转化.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
20.下列叙述正确的是( )
| A. | 1mol 任何气体的体积都约为22.4L | |
| B. | 1mol 任何物质在标准状况下所占的体积都约是22.4L | |
| C. | 标准状况下,1mol 水所占有的体积是22.4 L | |
| D. | 标准状况下,22.4L的任何气体的物质的量都约是1 mol |
14.下列物质间的转化在给定条件下不能实现的是( )
| A. | Al2O3$→_{△}^{NaOH(ap)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO |
18.下列除去杂质的方法正确的是( )
| A. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 | |
| B. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 | |
| D. | 除去乙烷中少量的乙烯:光照条件下通入Cl2,使乙烯转化成液态二氯乙烷而与乙烷分离 |
 .
.
 ;
;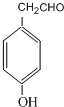 .
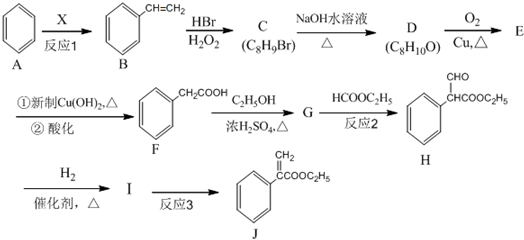
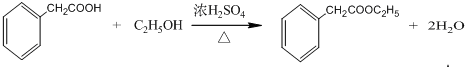
.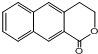 是一种重要的药物合成中间体,请结合题目所给信息,
是一种重要的药物合成中间体,请结合题目所给信息,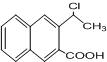 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
 碳酸钙可以降低胃酸的浓度而被用作胃药的抗酸剂.某中学研究性学习小组为测定一胃药中碳酸钙的含量,设计了如下的实验操作:
碳酸钙可以降低胃酸的浓度而被用作胃药的抗酸剂.某中学研究性学习小组为测定一胃药中碳酸钙的含量,设计了如下的实验操作: