题目内容
【题目】过去五年,环保部向水污染、大气污染宣战,生态环境保护取得明显成效。
Ⅰ.污水中硝酸盐浓度过高,会诱发一些水体产生亚硝胺类的致癌物质。
(1)在缺氧条件下,脱氮菌(反硝化菌)以甲醇作碳源,将NO3-还原成N2的过程如下:
反硝化作用过程:NO3-![]() NO2-
NO2-![]() NO
NO![]() N2O
N2O![]() N2
N2
阶段①会生成CO2,请写出此反应的离子方程式:__________________;阶段③生成的N2O是一种强温室气体,但却可用作火箭燃料的氧化剂,,其优点是___________________。
(2)Murphy等人通过调节溶液pH为10.25,利用铝粉将NO3-转变成N2,实现化学脱氮。
要转化0.01molNO3-,需_________gAl。
Ⅱ.CO2和CH4均为温室气体,如何减少它们的排放、充分利用能源是当今社会的重要课题。
(3)二氧化碳经催化氢化可转化成绿色能源乙醇。已知:
①2H2(g)+O2(g)=2H2O(g)△H= -483.6 kJ·mol-1
②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ·mol-1
③H2O(l)=H2O(g)△H=+44.0kJ·mol-1
则二氧化碳与氢气转化成乙醇和液态水的热化学方程式为:_________。
(4)CO2和CH4在催化剂作用下可转化为合成气(CO和H2):CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) △H=+247.3kJ·mol-1。向容积为1L的密闭容器中通入反应物和生成物共5.25mol,在T℃时发生反应,气体体积分数及化学反应速率与反应时间的关系如下图所示:
2CO(g)+2H2(g) △H=+247.3kJ·mol-1。向容积为1L的密闭容器中通入反应物和生成物共5.25mol,在T℃时发生反应,气体体积分数及化学反应速率与反应时间的关系如下图所示:
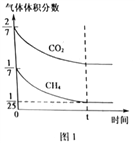
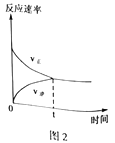
①T℃时,反应的平衡常数K=______。向平衡体系中再加入CO2、CH4、H2和CO各0.5mol,平衡将_________移动(填“向左”、“向右”或“不”)。
②写出一种既能加快化学反应速率又能提高CH4转化率的措施______________。
【答案】 3NO3-+CH3OH=3NO2-+CO2↑+2H2O 产物没有污染 0.45 2CO2(g)+6H2(g)=CH3CH2OH(l)+3H2O(l)△H=-348.0kJ·mol-1 64 向右 增大二氧化碳气体的浓度或升高温度
【解析】I.(1)本题考查氧化还原反应方程式的书写,甲醇为还原剂,被氧化成CO2,NO3-为氧化剂,被还原成NO2-,根据化合价升降法进行配平,离子反应方程式为3NO3-+CH3OH=3NO2-+CO2↑+2H2O;N2O在反应过程中,转化成N2,N2对环境无影响;(2)考查氧化还原反应的计算,0.01×5=m(Al)×3/27,解得m(Al)=0.45g;II.(3)考查热化学反应方程式的计算,CO2和H2反应方程式为2CO2+6H2→C2H6O+3H2O,因此有①×3-②-③×6得出:2CO2(g)+6H2(g)=CH3CH2OH(l)+3H2O(l)△H=-348.0kJ·mol-1;(4)本题考查化学平衡常数的计算、勒夏特列原理,①由图1和图2分析可知,起始时n(CO2)=1.5mol,n(CH4)=0.75mol,CO和H2只有一种存在且为3mol(因起始时刻v逆为0),设达到平衡时CO2转化量为xmol,
CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起始物质的量: 1.5 0.75 3(或0) 0(或3)
变化物质的量: x x 2x 2x
平衡物质的量: 1.5-x 0.75-x 3+2x(或2x) 2x(或3+2x) 达到平衡时甲烷的体积分数为1/25,因此有(0.75-x)/(5.25+2x)=1/25,解得x=0.25,根据化学平衡常数的定义,K=64,再向容器中各加入0.5mol四种气体,此时的浓度商为0.25<K,因此平衡向右进行;②根据影响化学反应速率的因素和勒夏特列原理,措施为增大CO2气体的浓度,因为正反应是放热反应,因此还可以升高温度。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】某化学兴趣小组拟通过中和滴定实验验证某品牌陈醋的酸度。
(1)查阅资料:
①食醋组成极为复杂,除水以外的主要成分是醋酸CH3COOH,此外还有其他各种有机物和一些无机物等微量成分,醋酸的含量远远多于其他成分的含量。另外其中含一些色素成分,使食醋呈棕色(白醋除外)。
②0.1 mol·L-1醋酸与氢氧化钠恰好完全反应时的pH约为________。
A.5.6 B.7.0 C.8.8 D.13.0
③包装显示该陈醋的酸度约是3.6 g/100 mL。
(2)由以上资料,同学们认为:
①测量时可以忽略老陈醋其他成分特别是有机酸所带来的影响。
②根据陈醋的特点,只能选用________来指示滴定终点。
A.甲基橙 B.酚酞 C.石蕊
③为使滴定时溶液中的醋酸浓度接近0.1 mol·L-1,应将10 mL样品醋稀释至________。
A.36 mL B.60 mL C.360 mL D.600 mL
(3)配制标准氢氧化钠溶液
由于NaOH在称量过程中极易吸水,配好的溶液浓度往往比预期偏小。故实验小组先用0.101 0 mol·L-1的KHP标准溶液准确测定NaOH溶液的浓度(KHP与NaOH按物质的量比1∶1完全反应)。向锥形瓶中盛入20.00 mL NaOH溶液时,应用________量取。
A.20 mL的量筒 B.100 mL的容量瓶 C.碱式滴定管 D.酸式滴定管
(4)用标准氢氧化钠溶液测定醋酸的浓度,并换算为酸度。
V(NaOH) | V(KHP)平均 | ||
20.00 mL | 18.00 mL | ||
V(稀释后的醋) | V(NaOH)平均 | ||
18.00 mL | 20.00 mL | ||
计算得出该陈醋样品的酸度为________ g/100 mL。(计算结果保留4位有效数字)