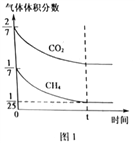
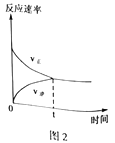
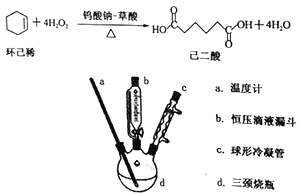
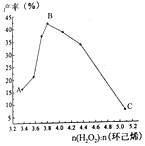
题目内容
【题目】某化学兴趣小组拟通过中和滴定实验验证某品牌陈醋的酸度。
(1)查阅资料:
①食醋组成极为复杂,除水以外的主要成分是醋酸CH3COOH,此外还有其他各种有机物和一些无机物等微量成分,醋酸的含量远远多于其他成分的含量。另外其中含一些色素成分,使食醋呈棕色(白醋除外)。
②0.1 mol·L-1醋酸与氢氧化钠恰好完全反应时的pH约为________。
A.5.6 B.7.0 C.8.8 D.13.0
③包装显示该陈醋的酸度约是3.6 g/100 mL。
(2)由以上资料,同学们认为:
①测量时可以忽略老陈醋其他成分特别是有机酸所带来的影响。
②根据陈醋的特点,只能选用________来指示滴定终点。
A.甲基橙 B.酚酞 C.石蕊
③为使滴定时溶液中的醋酸浓度接近0.1 mol·L-1,应将10 mL样品醋稀释至________。
A.36 mL B.60 mL C.360 mL D.600 mL
(3)配制标准氢氧化钠溶液
由于NaOH在称量过程中极易吸水,配好的溶液浓度往往比预期偏小。故实验小组先用0.101 0 mol·L-1的KHP标准溶液准确测定NaOH溶液的浓度(KHP与NaOH按物质的量比1∶1完全反应)。向锥形瓶中盛入20.00 mL NaOH溶液时,应用________量取。
A.20 mL的量筒 B.100 mL的容量瓶 C.碱式滴定管 D.酸式滴定管
(4)用标准氢氧化钠溶液测定醋酸的浓度,并换算为酸度。
V(NaOH) | V(KHP)平均 | ||
20.00 mL | 18.00 mL | ||
V(稀释后的醋) | V(NaOH)平均 | ||
18.00 mL | 20.00 mL | ||
计算得出该陈醋样品的酸度为________ g/100 mL。(计算结果保留4位有效数字)
【答案】 C B B C 3.636
【解析】(1)醋酸与NaOH恰好反应生成醋酸钠,溶液显碱性,pH稍大于7,只有pH=8.8符合,故答案为:C;(2)②根据陈醋的特点,碱滴定酸,选择酚酞为指示剂,滴定终点时无色变为红色,答案选B;③酸度约是3.6g/100mL,浓度为 =0.6mol/L,由稀释前后溶质的物质的量不变可知,稀释后的体积为
=0.6mol/L,由稀释前后溶质的物质的量不变可知,稀释后的体积为![]() =0.06L=60mL,答案选B;(3)先用0.1010mol/L 的KHP标准溶液准确测定NaOH溶液的浓度,则NaOH盛放在锥形瓶中,选择碱式滴定管准确量取,答案选C;(4)由n(醋酸)=n(NaOH)=n(KHP)可知,c(醋酸)=
=0.06L=60mL,答案选B;(3)先用0.1010mol/L 的KHP标准溶液准确测定NaOH溶液的浓度,则NaOH盛放在锥形瓶中,选择碱式滴定管准确量取,答案选C;(4)由n(醋酸)=n(NaOH)=n(KHP)可知,c(醋酸)=![]() =0.101mol/L,该陈醋样品的酸度为3.6g/100mL×
=0.101mol/L,该陈醋样品的酸度为3.6g/100mL×![]() =3.636g/100mL。
=3.636g/100mL。

 阅读快车系列答案
阅读快车系列答案【题目】一定温度下,在三个体积均为 1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g) + H2O(g) 下列说法正确的是( )
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
II | 387 | 0.40 | ||
III | 207 | 0.20 | 0.090 | 0.090 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器I中的CH3OH体积分数比容器II中的小
C. 容器I中反应到达平衡所需时间比容器III的长
D. 若起始时向容器I中充入0.15mol 的CH3OH、0.15mol 的CH3OCH3和0.10mol 的H2O,则反应将向正反应方向进行